
- •I Химическая термодинамика
- •1. Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
- •2. Тепловые эффекты реакции. Зависимость cp от t. Зависимость δh от t. Уравнение Киргофа,анализ.
- •3. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия
- •2 Начало термодинамики.
- •Расчет изменения энтропии для различных процессов
- •4. Вычисление абсолютной энтропии. Постулат Планка
- •1.5.1 Расчет абсолютной энтропии
- •5.Равновесные и обратимые процессы. Изохорно-изотермический потернциал
- •6. Изобарно-изотермический потенциал
- •9. Зависимость константы равновесия от температуры.
- •8.Химическое равновесие .Константы.
- •10. Расчет константы химического равновесия через изобарный потенциал.
- •Законы Рауля
- •16.Вычисление массы паровой и жидкой фазы. Связь между составом жидкой и паровой фаз
- •17. Азеотропные растворы
- •18. Фракционная перегонка
- •19. Ограниченная взаимная растворимость жидкостей
- •21. Повышение температуры кипения (эбулиоскопия). Понижение(криоскопия)
- •23. Удельная электропроводность. Ее зависимость от концентрации электролита
- •24 Эквивалентная электропроводность
- •26 Кондуктометрическое титрование
- •27. Электродные потенциалы. Стандартный водородный электрод
- •[Править]Устройство
- •28 . Уравнение Нернста для электродного потенциала Вывод уравнения Нернста
- •29. Классификация электродов . Электроды 1го рода
- •30. Электроды 2го рода.
- •31. ОкИслительно-восстановительные электроды. Хингидронный электрод
- •32. Гальванический элемент. Элемент даниэля-якоби
- •Характеристики гальванических элементов
- •Применение
- •Гальванический элемент Даниэля-Якоби
- •33 Концентрационный элемент
- •34. Определение рН разными цепями
- •35 Электрохимическая коррозия
- •36. Основные понятия химической кинетики. Порядок и молекулярность реакций
- •2.1.11 Кинетика двусторонних (обратимых) реакций
- •40. Скорость химических реакции.Катализ.
40. Скорость химических реакции.Катализ.
Для достижения химического равновесия при протекании обратимых реакций требуется определенный период времени, зависящей от природы веществ, составляющих реакционную систему. Для характеристики используется величина - скорость химической реакции. Скорость реакции - это величина, показывающая как изменяется концентрация одного из веществ в единицу времени. Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора. 1.Влияние температуры. Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
при повышении температуры на 10 0С скорость химической реакции возрастает в два - четыре раза. |

 Зависимость
скорости реакции от температуры
определяется правилом Вант - Гоффа :
Зависимость
скорости реакции от температуры
определяется правилом Вант - Гоффа :
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
2.Влияние катализатора. Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции. Влияние, оказываемое катализаторами на химические реакции, называется катализом.По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать: гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь; гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз). 3.Влияние концентрации реагирующих веществ.При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением. Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
Из кинетического уравнения уравнения нетрудно установить смысл коэффициента пропорциональности k, называемый константой скорости реакции. Она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от природы реагирующих веществ, но не зависит от их концентраций.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
температурный
коэффициент вычисляется по формуле:
![]()
41.
Уравне́ние
Арре́ниуса устанавливает
зависимость константы скорости химической
реакции ![]() от температуры
от температуры ![]() .
.
То
есть молекулы должны обладать некой
минимальной энергией (энергия
активации ![]() ),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией
),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией ![]() ,
пропорционально
,
пропорционально ![]() .
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
.
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
![]()
Здесь ![]() характеризует
частоту столкновений реагирующих
молекул,
— универсальная
газовая постоянная.
характеризует
частоту столкновений реагирующих
молекул,
— универсальная
газовая постоянная.
В рамках теории активных соударений зависит от температуры, но эта зависимость достаточно медленная:
![]()
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений на 10 %.
В рамках теории активированного комплекса получаются другие зависимости от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Аррениуса уравнение, температурная зависимость константы скорости к элементарной хим. реакции:
![]()
где A-предэкспоненциальныи множитель (размерность совпадает с размерностью к), Еа -энергия активации, обычно принимающая положит. значения, Т-абс. температура, k-постоянная Больцмана. Принято приводить Еа в расчете не на однумолекулу. а на число частиц NA = 6,02*1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в уравнении Аррениуса величину k заменяют газовой постоянной R. График зависимости 1nк от 1/kT (аррениусов график) – прямая линия, отрицательный наклон которой определяется энергией активации Еа и характеризует положит. температурную зависимость к.
Для
рассматриваемого процесса изменение
энергии ![]() реагирующих
частиц, которое вызывает заметное
изменение вероятности реакции (напр.,
вдвое), существенно меньше средней
тепловой энергии частицы kT.Если
это условие не выполняется, аррениусов
график отклоняется от прямой линии.
наиб. существенные отклонения от
уравнения Аррениуса обусловлены туннельным
эффектом,
когда в реакцию вступают частицы с
энергией много меньшей Eo,
Туннельный эффект, в частности, ответствен
за сильное нарушение аррениусовой
зависимости константы скорости в
условиях низких температур (при
реагирующих
частиц, которое вызывает заметное
изменение вероятности реакции (напр.,
вдвое), существенно меньше средней
тепловой энергии частицы kT.Если
это условие не выполняется, аррениусов
график отклоняется от прямой линии.
наиб. существенные отклонения от
уравнения Аррениуса обусловлены туннельным
эффектом,
когда в реакцию вступают частицы с
энергией много меньшей Eo,
Туннельный эффект, в частности, ответствен
за сильное нарушение аррениусовой
зависимости константы скорости в
условиях низких температур (при ![]() k
Т), когда
1nк при увеличении 1/k
Т перестает
убывать и принимает постоянное значение.
k
Т), когда
1nк при увеличении 1/k
Т перестает
убывать и принимает постоянное значение.
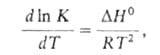
где ![]() -стандартное
изменение энтальпии реакции, которое
может принимать как положительные, так
и отрицат. значения.
-стандартное
изменение энтальпии реакции, которое
может принимать как положительные, так
и отрицат. значения.
