- •I Химическая термодинамика
- •1. Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
- •2. Тепловые эффекты реакции. Зависимость cp от t. Зависимость δh от t. Уравнение Киргофа,анализ.
- •3. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия
- •2 Начало термодинамики.
- •Расчет изменения энтропии для различных процессов
- •4. Вычисление абсолютной энтропии. Постулат Планка
- •1.5.1 Расчет абсолютной энтропии
- •5.Равновесные и обратимые процессы. Изохорно-изотермический потернциал
- •6. Изобарно-изотермический потенциал
- •9. Зависимость константы равновесия от температуры.
- •8.Химическое равновесие .Константы.
- •10. Расчет константы химического равновесия через изобарный потенциал.
- •Законы Рауля
- •16.Вычисление массы паровой и жидкой фазы. Связь между составом жидкой и паровой фаз
- •17. Азеотропные растворы
- •18. Фракционная перегонка
- •19. Ограниченная взаимная растворимость жидкостей
- •21. Повышение температуры кипения (эбулиоскопия). Понижение(криоскопия)
- •23. Удельная электропроводность. Ее зависимость от концентрации электролита
- •24 Эквивалентная электропроводность
- •26 Кондуктометрическое титрование
- •27. Электродные потенциалы. Стандартный водородный электрод
- •[Править]Устройство
- •28 . Уравнение Нернста для электродного потенциала Вывод уравнения Нернста
- •29. Классификация электродов . Электроды 1го рода
- •30. Электроды 2го рода.
- •31. ОкИслительно-восстановительные электроды. Хингидронный электрод
- •32. Гальванический элемент. Элемент даниэля-якоби
- •Характеристики гальванических элементов
- •Применение
- •Гальванический элемент Даниэля-Якоби
- •33 Концентрационный элемент
- •34. Определение рН разными цепями
- •35 Электрохимическая коррозия
- •36. Основные понятия химической кинетики. Порядок и молекулярность реакций
- •2.1.11 Кинетика двусторонних (обратимых) реакций
- •40. Скорость химических реакции.Катализ.
33 Концентрационный элемент
К онцентрационный
элемент —
это гальванический
элемент,
состоящий из двух одинаковых
металлических электродов,
опущенных в растворы соли этого металла с
различными концентрациями С1 >
С2.
Катодом в этом гальваническом элементе
является электрод погруженный в раствор
с большей концентрацией, а анодом
соответственно погруженным в раствор
с меньшей концентрацией[1].
онцентрационный
элемент —
это гальванический
элемент,
состоящий из двух одинаковых
металлических электродов,
опущенных в растворы соли этого металла с
различными концентрациями С1 >
С2.
Катодом в этом гальваническом элементе
является электрод погруженный в раствор
с большей концентрацией, а анодом
соответственно погруженным в раствор
с меньшей концентрацией[1].
В качестве примера концентрационного элемента можно привести концентрационный свинцовый гальванический элемент. Электроды этого элемента сделаны из свинца,
при этом один из электродов которого погружен в раствор соли свинца с концентрацией Pb2+ равной 0,1 моль/л, а другой — в раствор с концентрацией Pb2+ равной 0,01 моль/л.
Схема
данного элемента: ![]() В
данном элементе происходят электродные
процессы:
В
данном элементе происходят электродные
процессы:
![]() -
реакция восстановления
-
реакция восстановления
![]() -
реакция окисления
-
реакция окисления
34. Определение рН разными цепями
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») — мера активности (в очень разбавленных растворах она эквивалентнаконцентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифмактивности водородных ионов, выраженной в молях на литр:
![]()
Вывод значения pH
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
[править]pOH
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
![]()
как
в любом водном растворе при 22 °C ![]() ,
очевидно, что при этой температуре:
,
очевидно, что при этой температуре:
![]()
35 Электрохимическая коррозия
В основе коррозийных процессов лежат окислительно-восстановительные реакции металлов с окружающей средой, сопровождающиеся переходом металлов в более термодинамически устойчивое состояние.
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция
|
|
|
Катодная реакция – восстановление атмосферного кислорода:
|
|
|
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
|
2Fe + O2 + 4H+ → 2FeO + 2H2O. |
|
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9–10 коррозия железа практически прекращается. Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+. Вторая стадия коррозии соответствует реакции образования гидратированного оксида железа (ржавчины) Fe2O3∙nH2O (рис. 7.4):
|
4Fe2+ + O2 + 4H2O + xH2O = 2Fe2O3∙xH2O + 8H+. |
|
|
Рисунок 7.4 Коррозия железа кислородом воздуха, растворенным в воде |
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рис. 7.5).
|
Рисунок 7.5 Коррозия «белой жести» |
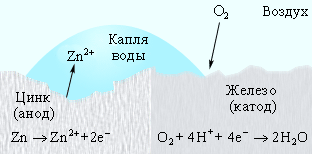
Оцинкованное железо ведет себя иначе. Поскольку цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рис. 7.6).
|
Рисунок 7.6 Катодная защита в оцинкованном железе |
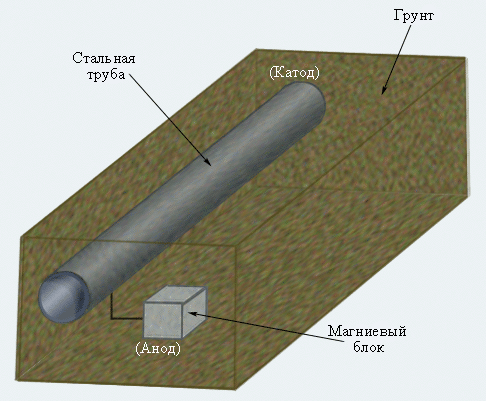
Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
|
Рисунок 7.7 Катодная защита подземного трубопровода |