
- •I Химическая термодинамика
- •1. Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
- •2. Тепловые эффекты реакции. Зависимость cp от t. Зависимость δh от t. Уравнение Киргофа,анализ.
- •3. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия
- •2 Начало термодинамики.
- •Расчет изменения энтропии для различных процессов
- •4. Вычисление абсолютной энтропии. Постулат Планка
- •1.5.1 Расчет абсолютной энтропии
- •5.Равновесные и обратимые процессы. Изохорно-изотермический потернциал
- •6. Изобарно-изотермический потенциал
- •9. Зависимость константы равновесия от температуры.
- •8.Химическое равновесие .Константы.
- •10. Расчет константы химического равновесия через изобарный потенциал.
- •Законы Рауля
- •16.Вычисление массы паровой и жидкой фазы. Связь между составом жидкой и паровой фаз
- •17. Азеотропные растворы
- •18. Фракционная перегонка
- •19. Ограниченная взаимная растворимость жидкостей
- •21. Повышение температуры кипения (эбулиоскопия). Понижение(криоскопия)
- •23. Удельная электропроводность. Ее зависимость от концентрации электролита
- •24 Эквивалентная электропроводность
- •26 Кондуктометрическое титрование
- •27. Электродные потенциалы. Стандартный водородный электрод
- •[Править]Устройство
- •28 . Уравнение Нернста для электродного потенциала Вывод уравнения Нернста
- •29. Классификация электродов . Электроды 1го рода
- •30. Электроды 2го рода.
- •31. ОкИслительно-восстановительные электроды. Хингидронный электрод
- •32. Гальванический элемент. Элемент даниэля-якоби
- •Характеристики гальванических элементов
- •Применение
- •Гальванический элемент Даниэля-Якоби
- •33 Концентрационный элемент
- •34. Определение рН разными цепями
- •35 Электрохимическая коррозия
- •36. Основные понятия химической кинетики. Порядок и молекулярность реакций
- •2.1.11 Кинетика двусторонних (обратимых) реакций
- •40. Скорость химических реакции.Катализ.
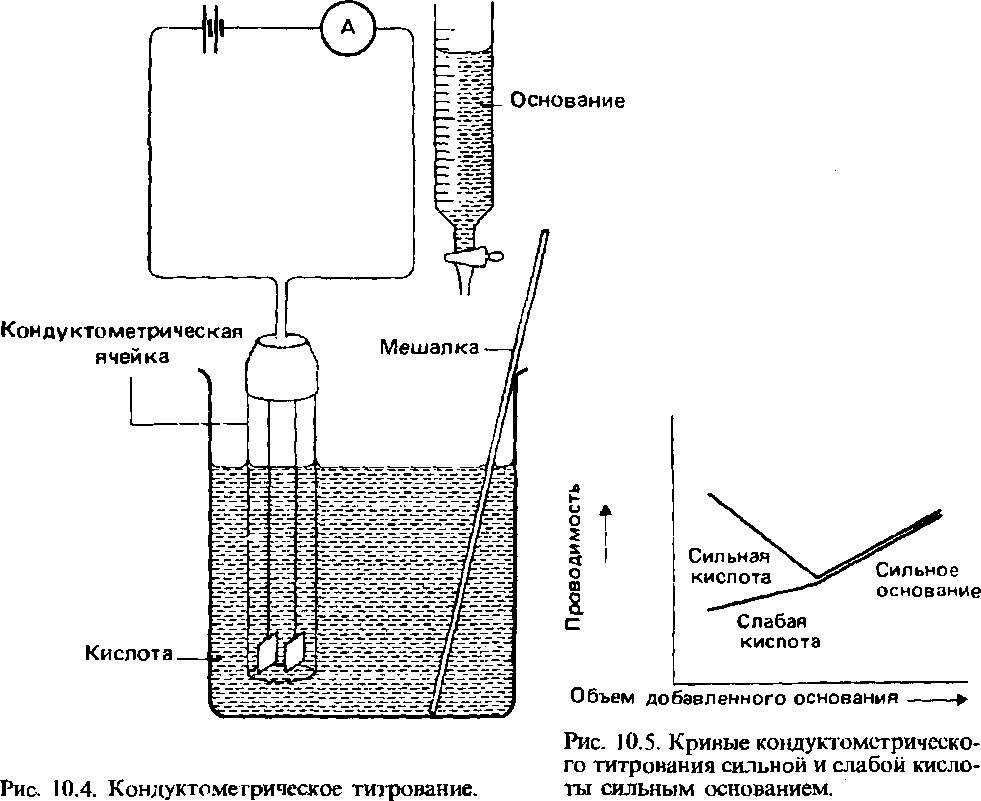
26 Кондуктометрическое титрование
При кислотно-основном титровании определение точки эквивалентности удобно осуществлять, измеряя проводимость (рис. 10.4) титруемого раствора через регулярные промежутки времени. Достижение точки эквивалетности обнаруживается по появлению резкого излома на кривой титрования. Конкретный вид кривой титрования зависит от констант диссоциации кислоты и основания. На рис. 10.5 показан типичный вид кривых титрования сильной кислоты сильным основанием и слабой кислоты сильным основанием.
Титрование любой кислоты любым основанием может быть представлено уравнением
![]()
B начале титрования сильной кислоты сильным основанием раствор имеет высокую проводимость, потому что сильная кислота полностью диссоциирована и, следовательно, концентрация ионов H3O+ высока. По мере добавления основания происходит удаление из раствора ионов H3O+ в результате реакции с ионами ОН-, и вследствие этого проводимость раствора постепенно уменьшается. В точке нейтрализации раствор не содержит ни избытка ионов H3O + , ни избытка ионов ОН". Следовательно, его проводимость в этот момент минимальна. Точка эквивалентности соответствует точке нейтрализации. Если после прохождения точки эквивалентности продолжается добавление основания, это значит, в раствор поступают новые ионы ОН". Это приводит к возрастанию проводимости раствора.
Титрование слабой кислоты сильным основанием можно объяснить на основе аналогичных рассуждений.
Кондуктометрическое титрование основано на измерении электропроводности или электросопротивления растворов в процессе титрования. Для этой цели применяют два одинаковых инертных электрода, расположенных на постоянном расстоянии друг от друга, и мостик переменного тока. [1]
Кондуктометрическое титрование применяют таю же для определения концентрации растворов солей. [2]
Кондуктометрическое титрование обладает рядом достоинств: возможно дифференцированное титрование смесей ряда кислот или оснований, титрование мутных, окрашенных растворов, а также возможно титрование при образовании гидролизующихся солей. [3]
Кондуктометрическое титрование принципиально применимо только к тем реакциям, в которых концентрация ионов в конечной точке заметно меньше, чем до или после нее. Этот метод почти неприменим к тем реакциям, где общая концентрация ионов велика и изменяется только незначительно в конечной точке. [7]
Кондуктометрическое титрование основано на том, что за ходом реакции следят по электрической проводимости титруемой среды между двумя инертными ( например, платиновыми) электродами, вычерчивают кривую зависимости электрической проводимости от объема прибавленного титранта. При титровании определяемого вещества раствором реактива получаются малодиссоциирующие или малорастворимые соединения, вследствие чего электрическая проводимость титруемого раствора заметно понижается. При этом минимум электрической проводимости на криэой наблюдается в конце титрования и соответствует точке эквивалентности. [8]
Кондуктометрическое титрование применяется при анализе смесей кислот и оснований. На рис. 6.3 показана кривая кондуктомет-ричвского титрования смеси соляной и уксусной кислот раствором NaOH. Участок ab соответствует титрованию соляной кислоты, be - уксусной, се. [9]
Кондуктометрическое титрование расширяет область применения титриметрического анализа, так как благодаря ему становится возможным титрование окрашенных и мутных растворов, когда переход окраски индикатора трудно наблюдать визуально; более - точно устанавливается конечная точка при титровании слабых кислот и оснований; при кондуктометрическом титровании можно использовать многие реакции осаждения и комплексообразования; при анализе смеси веществ повышается точность определений. Относительная ошибка определения находится в пределах 0 1 - 2 % в зависимости от определяемых концентраций. [10]
Кондуктометрическое титрование в отличие от обычного не требует применения индикаторов и может быть проведено в окрашенных, мутных, а также в очень разбавленных растворах. В процессе титрования за ходо. Конец титрования совпадает с перегибом на кривой электропроводность - объем добавленного раствора. Изменение электропроводности при кондуктометрическом титровании связано с заменой в растворе по мере протекания реакции одних ионов на другие с иной ионной проводимостью. [11]
Кондуктометрическое титрование находит широкое применение при анализе смесей кислот и оснований. На рис. 78 приведена кривая кондуктометрического титрования смеси соляной и уксусной кислот раствором аммиака. Первый излом кривой соответствует конечной точке титрования соляной кислоты, второй излом - конечной точке титрования уксусной кислоты. [12]
