
- •I Химическая термодинамика
- •1. Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
- •2. Тепловые эффекты реакции. Зависимость cp от t. Зависимость δh от t. Уравнение Киргофа,анализ.
- •3. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия
- •2 Начало термодинамики.
- •Расчет изменения энтропии для различных процессов
- •4. Вычисление абсолютной энтропии. Постулат Планка
- •1.5.1 Расчет абсолютной энтропии
- •5.Равновесные и обратимые процессы. Изохорно-изотермический потернциал
- •6. Изобарно-изотермический потенциал
- •9. Зависимость константы равновесия от температуры.
- •8.Химическое равновесие .Константы.
- •10. Расчет константы химического равновесия через изобарный потенциал.
- •Законы Рауля
- •16.Вычисление массы паровой и жидкой фазы. Связь между составом жидкой и паровой фаз
- •17. Азеотропные растворы
- •18. Фракционная перегонка
- •19. Ограниченная взаимная растворимость жидкостей
- •21. Повышение температуры кипения (эбулиоскопия). Понижение(криоскопия)
- •23. Удельная электропроводность. Ее зависимость от концентрации электролита
- •24 Эквивалентная электропроводность
- •26 Кондуктометрическое титрование
- •27. Электродные потенциалы. Стандартный водородный электрод
- •[Править]Устройство
- •28 . Уравнение Нернста для электродного потенциала Вывод уравнения Нернста
- •29. Классификация электродов . Электроды 1го рода
- •30. Электроды 2го рода.
- •31. ОкИслительно-восстановительные электроды. Хингидронный электрод
- •32. Гальванический элемент. Элемент даниэля-якоби
- •Характеристики гальванических элементов
- •Применение
- •Гальванический элемент Даниэля-Якоби
- •33 Концентрационный элемент
- •34. Определение рН разными цепями
- •35 Электрохимическая коррозия
- •36. Основные понятия химической кинетики. Порядок и молекулярность реакций
- •2.1.11 Кинетика двусторонних (обратимых) реакций
- •40. Скорость химических реакции.Катализ.
I Химическая термодинамика
1. Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
Внутренняя энергия системы (экстенсивное свойство).
Внутренняя энергия системы - энергия движения и взаимодействия частиц, из которых состоит тело (совокупность всех видов энергии частиц в системе).
Внутренняя энергия тела не зависит от положения тела относительно других тел и от скорости движения тела, от природы в-ва, его массы и параметров состояния сис-мы.
Внутренняя энергия слагается:
- из энергии хаотического движения молекул;
- из потенциальной энергии атомов, образующих молекулу или кристаллическую структуру;
- из внутриатомной энергии и т.д.
Внутренняя энергия тела может проявляться в форме теплоты или в форме работы, совершаемой телом.
Совокупность физических тел, изолированную от взаимодействия с другими телами, называют изолированной термодинамической системой. Состояние системы описывается с помощью параметров системы . К параметрам относятся объем V, температура Т. давление р, а также электрическая поляризация, намагниченность и др. При взаимодействии системы с внешними телами ее параметры изменяются. Уравнение, которое связывает между собой объем, температуру и давление называют уравнением состояния f = (p, V, T)=0. Внутренняя энергия тела складывается из кинетической энергии хаотичного теплового движения составляющих его частей (атомов или молекул) и потенциальнойэнергии их взаимодействия. Кинетическая и потенциальная энергия тела, как целого , во внутреннюю энергию не входит.
Теплота и работа.
Внутренняя энергия идеального газа определяется формулой
![]() где i- число степеней
свободы молекулы.
где i- число степеней
свободы молекулы.
Теплота – это форма передачи энергии от одной части системы к другой. Мера – количество теплоты. Теплота связана с процессом, а не с состоянием системы и не является функцией состояния, зависит от пути процесса.
Первый способ передачи энергии (обмен энергии в виде тепла) реализуется при непосредственном контакте тел, имеющих различную температуру, путём обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передаётся от более нагретого тела к менее нагретому, т.е. от тела, имеющего большую среднюю кинетическую энергию молекул, к телу с меньшей кинетической энергией молекул. Поскольку передача энергии этим способом происходит на молекулярном уровне, без видимого движения тел, то её называют микрофизической формой передачи энергии. Количество энергии, переданной первым способом от одного тела к другому, называют количеством теплоты, или просто теплотой.
Второй способ – Обмен энергией м/у сис-мой и внешней средой обуславливается работой, совершаемой системой или над системой.Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объём под действием внешнего давления. Иначе говоря, в этом случае передача энергии происходит при условии перемещения всего тела или его части в пространстве. Поэтому второй способ будет макроскопической формой передачи энергии. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе - работой.
В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно отметить, что в различных термодинамических процессах, в зависимости от условий их протекания, количество теплоты и работы будет также различно.
Следовательно, теплота и работа являются функциями процесса, а не состояния.
Энтальпия (Н) - термодинамическая функция, являющаяся функцией состояния как и внутренняя энергия (U). Ее величина определяется из простого соотношения:
Н = U + pV, (1.5)
где р - давление;
V - объем системы.
При рассмотрении процессов, происходящих в изохорических условиях удобно пользоваться внутренней энергией, а при рассмотрении изобарных процессов - энтальпией.
Первое начало термодинамики.
Это частный случай закона сохранения энергии в Макросистемах.
1) Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
2) Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе и не зависит от способа, которым осуществляется этот переход.
Первое начало термодинамики представляет собой закон сохранения энергии систем , в которых основное значение имеют тепловые процессы. Количество теплоты , переданное системе , расходуется на изменение ее внутренней энергии и на работу , совершаемую системой против внешних сил. Q=ΔU+A
Первое начало термодинамики устанавливает эквивалентность теплоты и работы . Если система совершает цикл и возвращается в исходное состояние (Δ U), то Q=A. Таким образом, работа может быть совершена системой за счет переданного ей количества теплоты.
Из этого закона вытекает – невозможность создания вечного двигателя первого рода, который производил бы работу, не затрачивая на это энергии.
Закон Гесса.
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания (промежуточных состояний системы).
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
В основе термохимии лежит закон, согласно которому тепловой эффект реакции не зависит от пути этой реакции, а определяется видом и состоянием исходных и конечных продуктов реакции.
Гесс Герман Иванович (1802 – 1850 г. г.) – русский химик, академик Петербуржской Академии наук.
Существо закона вытекает из уравнения первого начала термодинамики:
QV
= - V,
а QP
= -
H.
V,
а QP
= -
H.
U и Н – функции состояния, поэтому QV и QP также функции состояния системы.
Иллюстрация закона Гесса.
C + O2 = CO2 + Q1, (3.13)
есть первый вариант реакции в системе.
C
+
 O2
= CO + Q2,
O2
= CO + Q2,
CО + O2 = CO2 + Q3, (3.14)
второй возможный вариант реакции.
Так из одинакового исходного состояния образуется одинаковое для рассмотренных вариантов конечное состояние, то:
Q1 = Q2 + Q3. (3.15)
Закон Гесса имеет огромное практическое значение. С его помощью устанавливаются значения тепловых эффектов реакций, экспериментальное определение которых затруднительно.
Для этих целей широко используются следствия из закона Гесса.
Следствия из закона Гесса.
I следствие. Тепловой эффект реакции разложения какого-либо химического соединения равен по абсолютной величине, но противоположен по знаку тепловому эффекту реакции образования этого соединения.
II следствие. Если совершаются две реакции, приводящие из различных исходных состояний к одинаковым конечным, то разница между тепловыми эффектами реакций представляет собой тепловой эффект перехода из одного исходного состояния в другое.
III следствие. Если совершаются две реакции, приводящие из одинаковых исходных состояний к различным конечным, то разница их тепловых эффектов есть тепловой эффект реакции перехода из одного конечного состояния в другое.
IV следствие. Тепловой эффект химической реакции равен сумме теплот образования конечных и исходных продуктов реакции с учетом коэффициентов перед химическими формулами этих продуктов в уравнении химической реакции.
В аналитической форме записи:
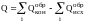 ,
(3.16)
,
(3.16)
где Q – тепловой эффект химической реакции;
 - теплоты образования
конечных и исходных продуктов реакции
соответственно.
- теплоты образования
конечных и исходных продуктов реакции
соответственно.
Теплота образования – тепловой эффект химической реакции образования данного вещества (продукта химической реакции) из простых, устойчивых в данных условиях. Стандартной теплотой образования называют теплоту образования, отнесенную к температуре 298 К и давлению 1,01 * 105 Па. Если известна эта величина, то термохимический расчет позволяет определить теплоту образования и при других значениях параметров состояния.
V следствие. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных и конечных продуктов химической реакции с учетом коэффициентов у химических формул этих веществ в уравнении химической реакции.
В аналитической форме записи:
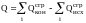 ,
(3.17)
,
(3.17)
где
 - теплоты сгорания конечных и исходных
продуктов реакции соответственно.
- теплоты сгорания конечных и исходных
продуктов реакции соответственно.
Теплота сгорания – тепловой эффект реакции сгорания 1 моля вещества в атмосфере чистого кислорода до образования высшего оксида.
Теплота сгорания существенно зависит от температуры, поэтому для термохимических расчетов вводится некоторая точка отсчета – стандартная теплота сгорания. Стандартной теплотой сгорания называется теплота сгорания, отнесенная к стандартным условиям, т. е. к 298 К и р = 1,01*105 Па.
VI следствие. Теплота растворения.
Теплотой растворения называется количество теплоты, выделяемое или поглощаемое при растворении 1 моля вещества в таком количестве растворителя, при котором его дальнейшее добавление к раствору уже не вызывает изменение температуры последнего.
В этой связи табличные значения теплот относятся к раствору 1 моля растворяемого вещества в 200 – 400 молях растворителя.
Теплота растворения (q) – сумма двух слагаемых:
q = q1 + q2, (3.18)
где q1 – теплота, затрачиваемая на перевод вещества из обычного состояния в то, в котором оно находится в растворе;
q2 – теплота взаимодействия частиц растворителя с частицами растворенного вещества (теплота сольватации или гидратации, если растворитель вода).
VII следствие. Теплота плавления и испарения.
Процессы плавления и испарения всегда эндотермические процессы, т. к. на их реализацию необходимо затратить значительную энергию на разрушение данного порядка в структуре вещества.
Между
теплотой испарения (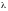 )
и температурой кипения (ТЕ)
существует взаимосвязь:
)
и температурой кипения (ТЕ)
существует взаимосвязь:
 ,
(3.19)
,
(3.19)
определяемая как правило Трутона.
Существует
такая же взаимосвязь для теплоты
плавления ( )
и температуры плавления (TS):
)
и температуры плавления (TS):
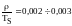 ,
(3.20)
,
(3.20)
называемая правилом Ричардса.
VIII следствие. Теплота нейтрализации.
Реакция нейтрализации – реакция между щелочами и кислотами. В ее основе лежит процесс нейтрализации ионов водорода (Н+) ионами гидроксида (ОН-), приводящий к образованию молекул воды. Следовательно, тепловой эффект всех подобных реакций должен быть одинаков, что и показали точные опыты.
Теплота нейтрализации примерно равна 57,08 кДж/моль, если в реакции участвует одноосновная кислота
Теплоты образования веществ из элементов.
Теплота любой реакции (даже пока не осуществленной на практике) может быть вычислена как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции.
Принято использовать теплоты образования соединений из чистых элементов в стандартных условиях. Такие стандартные условия чаще называют стандартным состоянием веществ:
1. Для твердых, жидких и газообразных веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25 оС (298 К) и давлении 1 атмосфера (1 атм).
2. Теплота образования чистых элементов по определению равна нулю.
Во многих случаях
эти реакции протекают при постоянном
объеме или постоянном давлении. Из
первого закона термодинамики следует,
что при этих условиях теплота является
функцией состояния. При постоянном
объеме теплота равна изменению внутренней
энергии:
![]()
![]()
а при постоянном
давлении - изменению энтальпии:
![]()
![]() Эти равенства в применении к химическим
реакциям составляют суть закона Гесса:
Эти равенства в применении к химическим
реакциям составляют суть закона Гесса:
Из закона Гесса можно сформулировать два полезных следствия:
1. Тепловой эффект реакции равен алгебраической сумме теплот
образования продуктов реакции за вычетом суммы теплот образования
исходных веществ, т.е.
∆H = ∑ ∆H f − ∑ ∆H f . (3)
продукты исходн.
2. Тепловой эффект реакции равен алгебраической сумме теплот сгорания
исходных веществ за вычетом суммы теплот сгорания
продуктов реакции, т.е.
∆H = ∑ ∆H сгор. − ∑ ∆H сгор. . (4)
исходн. продукты
Закон Гесса дает возможность устанавливать тепловые эффекты реакций,
которые невозможно или трудно осуществить в экспериментальных условиях.
