
- •4. Классификации аминокислот.
- •5) Физико-химические свойства белка. Обратимое и необратимое осаждение белка.
- •6) Этапы денатурации и ренатурации белков.
- •38. Окислительное декарбоксилирование пирувата, механизм и биологическая роль.
- •39. Цикл трикарбоновых кислот, химизм, энергетический эффект, внутриклеточная
- •40. Распад гликогена (гликогенолиз). Химизм, энергетический эффект окисления глюкозы, связь с гликолизом
- •44. Холестерин и его производные: строение, свойства и функции.
- •45. Жирные кислоты: строение, свойства и функции.
- •46. Простагландины, их биологическая роль.
- •48.Структура ц-амф, биологическая роль. Регуляция содержания цАмф в клетках.
- •50.Строение, биологическая роль, механизм действия тиреоидных гормонов.
- •51.Инсулин, строение, биологическая роль, механизм действия.
- •Строение
- •Действие инсулина
- •52.Гормоны мозгового слоя надпочечников, строение, биологическая роль, механизм действия (на примере адреналина).
- •59. Витаминоподобные вещества: строение, свойства и функции в организме.
- •60. Антивитамины: строение, свойства и механизм действия.
6) Этапы денатурации и ренатурации белков.
Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов(температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи и т.д). При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка. При денатурации происходит разрыв нековалентных (в первую очередь водородных) связей в молекуле белка, что сопровождается нарушением четвертичной, третичной и частично вторичной структур белка без каких-либо изменений первичной структуры. Разрыв нековалентных связей приводит к тому, что компактная молекула белка превращается в беспорядочный клубок.
Р азличают
2 вида денатурации:1)Обратимая денатурация
– ренатурация или ренактивация – это
процесс, при котором денатурированный
белок, после удаления денатурирующих
веществ вновь самоорганизуется в
исходную структуру с восстановлением
биологической активности. 2)необратимая
денатурация – это процесс, при котором
биологическая активность не
восстанавливается после удаления
денатурирующих агентов.
азличают
2 вида денатурации:1)Обратимая денатурация
– ренатурация или ренактивация – это
процесс, при котором денатурированный
белок, после удаления денатурирующих
веществ вновь самоорганизуется в
исходную структуру с восстановлением
биологической активности. 2)необратимая
денатурация – это процесс, при котором
биологическая активность не
восстанавливается после удаления
денатурирующих агентов.

10.Характеристика простых и сложных белков, классификация, основные представители, их биологические функции.
Белки – это высокомолекулярные биополимеры, состоящие из остатков аминокислот.
Функции белков.
1) структурная (пластическая, опорная) – определяет структуру тела человека, растений, животных, вирусов, микроорганизмов, входят в состав различных биологических мембран. Имеется целая группа белков, для которых эта функция является основной – коллагены, эластины, кератины.
2) Каталитическая – белки обладают свойствами биокатализаторов (ферментов), ускоряя течение биологических процессов в организме.
3) Энергетическая – за счет части аминокислот. На долю белка приходится 10-20% энергопотребления у человека.
4) Транспортная – белки переносят с кровью и другими биологическими жидкостями вещества, нерастворимые в воде (витамины, металлы, липиды, газы) и способствуют транспорту этих веществ через мембраны.
5) Защитная – а) белки стоят на страже химической индивидуальности вида (при поступлении чужеродного белка – антигена, несущего «чужую» генетическую или химическую информацию в организме вырабатываются антитела, образуется комплекс антиген-антитело и он исключается из метаболического круга путем осаждения, лизиса и т.д. б) защита организма при ранении путем свертывания крови (только у млекопитающих). Д) интерфероны – блокируют синтез вирусных белков путем индукции синтеза ряда внутриклеточных ферментов.
6) Сократительная – обеспечивает способность к перемещению тела в пространстве, сокращение сердца, дыхание, перистальтику кишечника и др.
7) Регуляторная – белки играют важную роль в обменных процессах, осуществляют связь внутренней среды организма с внешней средой. Это гормоны, ферменты, БАВ, пептиды и т.д.). Рецепторы, через которые осуществляются регуляторные процессы также являются белками.
8) Трансформирующая – белки участвуют в превращении электрической и осмотической энергии в химическую энергию АТФ.
9) Передача наследственных признаков. Белки «запускают» процесс передачи наследственной информации и контролируют его на всем протяжении.
Классификация белков.
По химическому составу белки делятся на 2 класса – простые (при гидролизе распадаются только на аминокислоты), сложные (при гидролизе дают не только аминокислоты, но и другие структуры – простетические группы). Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные имеют шарообразную форму молекулы, растворимы в воде и солевых растворах. К этой группе относятся все ферменты и большинство других БАБ, исключая структурные. Среди глобулярных белков можно выделить альбумины, глобулины, протамины и гистоны. Фибриллярные белки характеризуются волокнистой структурой, делятся на растворимые и нерастворимые. К первой подгруппе относятся миозин, актин, фибриноген, ко второй – склеропротеины (протеноиды – кератины, эластины, коллагены). Сложные белки – НП, МП, ГП, ФП, ХП, ЛП. Такое деление белков условно, поскольку многие простые белки также содержат небелковый компонент.
Представители
Фосфопротеиды - строение, представители, значение.
ФП это сложные белки, обособленной простетической группы не имеют. Ее роль выполняют остатки фосфорной кислоты, связанные сложноэфирными связями с гидроксильными группами оксиаминокислот: сер, тре, тир. Значение ФП – они служат пластическим материалом (источники незаменимых аминокислот и фосфора) и играют важную роль в росте организма, поэтому особенно нужны детям.
Хромопротеиды — строение, представители, значение.
ХП это окрашенные белки (chroma – краска). Молекулы состоят из простого белка и простетической группы, окрашенной обычно за счет металла или витамина. Среди ХП различают дыхательные белки и дыхательные ферменты, которые образуют подгруппу гемопротеидов. Кроме гемопротеидов в группу ХП входят пигменты (родопсин, меланин), магний-порфирины (хлорофилл), желтые ферменты – флавиновые ферменты (выполняют роль дыхательных ферментов).
К дыхательным белкам относятся гемоглобин (Нb) – красный пигмент крови и миоглобин (Мgb) – красный пигмент мышц.
11.Гемопротеиды, основные представители. Строение гема. Кооперативный механизм связывания кислорода гемоглобином.
Гемоглобин состоит из простого белка типа гистонов – глобина и 4-х гемов (простетическая группа). Глобин состоит из 2-х п/п альфа цепей (по 141 аминокислоте в каждой) и 2-х бета-цепей (по 146 аминокислот в каждой). Видовая специфичность гемоглобина обусловлена особенностями аминокислотного состава глобина. Например, в глобине человека нет иле. Глобин, соединяясь с гемом, превращает малорастворимую и инертную структуру в хорошо растворимую и активную форму, способную связывать кислород. В свою очередь гемы придают устойчивость большим молекулам глобина.
Гем – производное порфирина, состоит из 4-х пиррольных колец, связанных в циклическую структуру метиновыми мостиками. Порфин с заместителями у бета-углерода называется порфирином. Различные порфирины различаются друг от друга характером заместителей. Гемы гемоглобина у 1,3,5,8 атомов углерода содержат СН3 группу (метил), у 2,4 – винильные радикалы, у 6,7 – остатки пропионовых кислот. Соединяясь с ионом железа, порфирин образует гем. железо присоединяется к атомам азота II и IV колец ковалентными и к III и I колец нековалентными (координационными связями). Строение всех 4-х гемов идентичное – показать на табл или пленке и дать списать. Каждый гем соединен с одной п/п цепью (a или b) двумя координационными связями иона железа с имидазольными кольцами гистидинов. Одна из этих связей постоянна, а другая разрывается, когда к гемоглобину присоединяется кислород.
В 1957 году биохимики Д.Кендрью и М.Перутц получили Нобелевскую премию за расшифровку строения молекулы гемоглобина.
Во время развития организма гемоглобин претерпевает определенные изменения: на ранних стадиях у эмбриона содержится эмбриональный гемоглобин Е, который после 3-4 месяцев развития заменяется фетальным F, содержащим 2 a и 2 g цепи. Кровь новорожденного содержит 80% фетального гемоглобина, но к концу первого года жизни он почти полностью заменяется на гемоглобин А. В крови взрослого человека все же присутствует 1,5% фетального гемоглобина. Он имеет большее сродство к кислороду, чем гемоглобин взрослого организма – гемоглобин А и обеспечивает снабжение плода кислородом при меньшем его парциальном давлении. В дополнение к основному гемоглобину взрослого человека А1, имеется гемоглобин А2, молекула которого состоит из 2 a цепей и 2 s цепей. На долю гемоглобина А2 приходится 2,5% от всего гемоглобина.
Роль гемоглобина. Гемоглобин – основной белок эритроцитов. В 1-ом эритроците содержится 340 млн молекул гемоглобина, каждая из которых состоит из 103 атомов С, Н, О, N, S и 4 атомов железа. Основная роль – перенос кислорода от легких к тканям (оксигенация – показать на доске) и углекислого газа от тканей к легким. Гемоглобин образует буферные системы, которые участвуют в поддержании КОС. При распаде гемоглобина образуются пигменты кала, мочи и желчи. Гемоглобин участвует в обезвреживании оксида азота, который может присоединяться к нему и образовывать нитрозгемоглобин.
Молекула миоглобина состоит из 1-го гема и 1-ой п/п цепи (из 153 аминокислот). Гем миоглобина такой же как у гемоглобина. Роль миоглобина – транспорт кислорода от оксигемоглобина к ферментам дыхательной цепи в клетке – показать на доске реакцию.
Содержится, в основном, в цитоплазме мышечных клеток. Также служит в качестве депо кислорода. Миоглобина больше в натренированных мышцах – у диких животных, особенно у ныряющих – кашалота, тюленей (например, у зайца больше, чем у кролика). Миоглобин специфический белок мышц, поэтому его появление вы сыворотке крови говорит о поражении мышечной ткани (заболевания мышц, инфаркт миокарда).
25.Понятие о ферментах. Свойства ферментов как биокатализаторов.
Ферменты, или энзимы - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах.
Свойства ферментов как биокатализаторов:
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только Lлактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом хи мической связи (один фермент – одна связь). Пример пептидазы, эстеразы, гликозидазы.
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реак ции, как и все химические реакции, ускоряются при повышении температуры (в 24 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурныйопти мум, превышение которого приводит к понижению активности ферментов изза тепловой денатурации их молекул. Для большинства ферментативных реакций температурный опти мум 3840оС, а при 5060оС и выше скорость ферментативных реакций сильно уменьшается изза разрушения молекул фермента (искл. миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Фер менты лучше сохраняются при низких температурах – их активность снижается, но денату рации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
3) ЗависимостьферментативнойактивностиотрНсреды. Каждый фермент имеет свой рН– оптимум значение рН, при котором его активность максимальна. Фермент, как и любой бе лок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами. Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее актив ны при рН=68. Исключения пепсин (рНопт=1,52), аргиназа (рНопт=1011).
4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа)
5) Активность ферментов может изменяться под влиянием различных веществ, которые мо гут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции.
6) Ферменты в отличие от небиологических катализаторов проявляют более высокую актив ность и проявляют свою способность ускорять реакции в очень маленьких концентрациях (например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3).
7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Фермен ты не входят в состав конечных продуктов реакции, не влияют на константу равновесия ре акции, а только увеличивают скорость ее достижения.
26. Активный центр ферментов, его структурно-функциональная неоднородность. Единицы активности ферментов.
Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа Установлено, что у сложных ферментов в состав активного центра входят также просте-тические группы.
В активном центре условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную («якорную») площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом.
В связи с введением Международной системы единиц (СИ) предложено новое выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с). Отношение международной единицы (U) к каталу можно выразить следующим образом: 1 кат = 1 моль•с–1 = 60 моль•мин–1 = 60•106 мкмоль•мин–1 = 6•107 U, или: 1 U = 1 мкмоль•мин–1 = (1/60) мкмоль•с–1 = (1/60) мккат = 16,67 нкат. Таким образом, 1 U фермента соответствует 16,67 нкат.
27.Механизм действия ферментов. Значение образования фермент субстратного комплекса в процессе катализа.
В этом вопросе читайте всё!!!!
Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения изменения энергетики химических реакций и с точки зрения событий в активном центре.
А. Энергетические изменения при химических реакциях
Любые химические реакции протекают, подчиняясь двум основным законам термодинамики: закону сохранения энергии и закону энтропии. Согласно этим законам, общая энергия химической системы и её окружения остаётся постоянной, при этом химическая система стремится к снижению упорядоченности (увеличению энтропии). Для понимания энергетики химической реакции недостаточно знать энергетический баланс входящих и выходящих из реакции реагентов, необходимо учитывать изменения энергии в процессе данной химической реакции и роль ферментов в динамике этого процесса. Рассмотрим реакцию разложения угольной кислоты:
Н2СО3 → Н20 + С02.
Угольная кислота слабая; реакция её разложения пойдёт цри обычных условиях, если молекулы угольной кислоты имеют энергию, превышающую определённый уровень, называемый энергией активации Еа (рис. 2-10).
Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений. Говорят, что молекулы, обладающие Еа, находятся в переходном состоянии. Разницу энергий между исходным реагентом Н2СО3 и конечными соединениями Н2О и СО2 называют изменением свободной

В механизме ферментативного катализа решающее значение имеет образование нестойких промежуточных соединений - фермент-субстратный комплекс ES, подвергающийся превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции.
Таким образом, биологические катализаторы (ферменты) не изменяют свободную энергию
93
субстратов и продуктов и поэтому не меняют равновесие реакции (рис. 2-11).
Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов.
Сходство ферментов с небиологическими катализаторами заключается в том, что:
ферменты катализируют энергетически возможные реакции;
энергия химической системы остаётся постоянной;
в ходе катализа направление реакции не изменяется;
ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
ферменты обладают высокой специфичностью;
ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении рН;
скорость ферментативной реакции может регулироваться.
Молекулярные механизмы ферментативного катализа
1.стадия-образование ферментного комплекса
E+S↔[ES]
2.стадия активации субстрата в ферм. – субстр. комлексе
[ES] ↔ [ES]’
3. стадия-образование ферментного комплекса
[ES]’ ↔ [EP]
4.стадия-разложения ферм. Комплекса на ферм-е продукты
[EP] ↔ E+P
Продукты реакции образуются только при распаде фермент-субстратного комплекса. Необходимо отметить, что в образовании фермент-субстратного комплекса участвует несколько функциональных групп фермента, но только некоторые пары из них ( субстрата и фермента) ответственны за ферментативный катализ, а другие группы служат для создания связи фермента с субстратом.
28.Уравнение скорости ферментативной реакции Михаэлиса и Ментен. Константа Михаэлиса (Км), определение, характеристика.
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативнойкинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
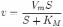 ,
,
где
 —
максимальная
скорость реакции, равная
—
максимальная
скорость реакции, равная  ;
;
 —
константа
Михаэлиса, равная концентрации субстрата,
при которой скорость реакции составляет
половину от максимальной;
—
константа
Михаэлиса, равная концентрации субстрата,
при которой скорость реакции составляет
половину от максимальной;
 —
концентрация
субстрата.
—
концентрация
субстрата.
Константа Михаэлиса, Км - кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату: чем меньше значение К.М., тем сильнее связывание фермента с субстратом. Такие ферменты, как карбоангидраза и каталаза, требуют относительно высокой концентрации субстрата для достижения скорости, равной половине максимальной. Другие же ферменты, напр. гексокиназа мозга, катализирующая перенос фосфатной группы от АТФ (см. Аденозинтрифосфат, АТФ) на глюкозу, достигают скорости, равной половине максимальной, при очень низкой концентрации субстрата. Ферменты, имеющие два или более субстрата, такие как гексокиназа или аспартатамино-трансфераза, могут иметь различные значения Км для разных субстратов. Если фермент, напр. химотрипсин, действует на несколько разных субстратов, имеющих какую-то общую структурную особенность, то величины Км для всех этих субстратов могут значительно различаться.
29. Зависимость скорости реакции от концентрации субстрата, температуры и рН среды.
от конц. Субстата
Скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:
V= D[S]/t = D[P]/t.
от температуры среды
Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы (рис. 2-17).

Рис. 2-17. Зависимость скорости ферментативной реакции (V) от температуры
От pH среды
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения рН у разных ферментов различный (рис. 2-18). Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН .

Рис. 2-18. Зависимость скорости ферментативной реакции (V) от рН среды.
30. Механизм действия активаторов и ингибиторов на скорость реакции. Ингибиторы, их типы.
Скорость ферментативной реакции (равно активность ферментов) определяется присутствием в среде ингибиторов и активаторов , среди которых могут быть как посторонние для организма вещества, так и природные продукты обмена.
И н г и б и т о р а м и называют вещества, вызывающие частичное или полное торможение химических реакций, включая и ферментативные.
Ферменты теряют каталитическую активность при воздействии различных факторов, вызывающих денатурацию (нагревание, кислоты, щелочи, соли тяжелых металлов и др.). Подобное разрушение фермента не рассматривается как ингибирование, так как оно не связано с механизмом действия фермента. Ингибиторы действуют на скорость реакции определенным химическим путем.
Механизм действия ингибиторов может быть самым разнообразным, но в общей форме можно сказать, что ингибитор вступает в соединение с ферментом, образуя соединение фермент-ингибитор.
Различают обратимое и необратимое ингибирование фермента. При обратимом ингибировании активность фермента восстанавливается по мере удаления свободного ингибитора диализом или иным способом, т.е. при обратимом ингибировании существует равновесие между свободным ингибитором и ферментом. При необратимом ингибировании равновесие между свободным ингибитором и ферментом не устанавливается и активность фермента не удается восстановить диализом. Напротив, если ингибитор присутствует в избытке по сравнению с ферментом, то со временем наступает полное торможение активности фермента.
Обратимое ингибирование ферментативных реакций бывает конкурентным и неконкурентным.
Конкурентное ингибирование может быть вызвано веществами, похожими по своей структуре на субстрат. Эти вещества, конкурируя с субстратом, соединяются с активным центром фермента, но не подвергаются ферментативному превращению и новые продукты из них не образуются. В связи с тем, что часть фермента при конкурентном ингибировании расходуется на образование комплеса фермент-ингибитор, скорость ферментативной реакции снижается. Конкурентное ингибирование обратимо, так как при увеличении концентрации субстрата скорость реакции возрастает.
Неконкурентное ингибирование вызывают вещества, не имеющие структурного сходства с субстратом. Причем эти вещества обратимо присоединяются к ферменту не в активном центре, где обычно связывается субстрат, а совсем в другом месте и, следовательно, конкуренция между субстратом и ингибитором отсутствует. Связываясь с ферментом, неконкурентные ингибиторы вызывают изменение пространственной структуры активного центра, и, хотя присоединение субстрата к такому активному центру происходит, тем не менее катализ становится невозможным. Неконкурентные ингибиторы связываются обратимо как со свободным ферментом, так и с фермент-субстратным комплексом, образуя неактивные фермент-ингибитор (ЕJ) и (или) фермент-субстрат-ингибитор (ESJ).
Наряду с инигибиторами существует целый ряд активаторов ферментов. А к т и в а т о р а м и называют вещества, увеличивающие каталитическую активность ферментов. Среди активаторов встречаются самые разнообразные вещества. Особенно часто роль активаторов ферментов выполняют ионы металлов: калия, кальция, магния, цинка, меди, железа, марганца, кобальта, а из анионов - хлора. Для проявления максимальной активности ферментов требуется определнная концентрация ионов-активаторов в среде.
32. Изоферменты, множественные молекулярные формы ферментов, их свойства,регуляторная функция.
Изоферменты-это ферменты, катализирующие идентичные реакции, но отличающиеся друг от друга строением и каталитическими свойствами. К изоферментам относят только те формы ферментов, появление которых связано с генетически детерминированными различиями в первичной структуре пептидной цепи.
Множественные формы ферментов можно разделить на две категории:
Изоферменты
Собственно множественные формы (истинные)
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию.
Свойства ферментов:
Ферменты характеризуются следующими основными свойствами. . Высокая каталитическая активность (углекислый газ из крови связывается с гемоглобином в карбогемоглобин со скоростью 10 молекул в секунду, а при ферменте карбоангидраза в 10 раз больше).
2. Специфичность (избирательность) действия (один фермент катализирует одну реакцию).
3. Регулируемость активности ферментов (внутренняя среда организма из-за действия ферментов всегда постоянна).
Факторы влияющие на активность ферментов.
1. Концентрация фермента и субстрата (чем выше концентрация исходных веществ, тем выше скорость реакции).
2. Активная реакция среды (рН) (большинство ферментов проявляют максимальную активность при значении рН=7 (нейтральная). Некоторые активны только в кислой среде (пепсин рН=2), некоторые только в щелочной (липаза рН=9). При физических нагрузках в мышцах накапливается молочная кислота, способная закислять среду и снижать активность многих ферментов).
3. Температура (Различные клеточные ферменты работают в своем диапазоне температур, где они проявляют наибольшую активность (средние температуры 37-40 С) При низких температурах активность ферментов замедляется, при высоких фермент(белок) разрушается (денатурация белка). При замораживании фермент сохраняет свою структуру и затем при размораживании восстанавливает свои свойства).
4. Активаторы и ингибиторы (ионы металлов, низкомолекулярные вещества) активаторыповышают активность фермента (АТФ-аза миозина мышц активируется ионами Са ), ингибиторыснижают активность фермента, т.к. занимают место субстрата (конкурентные ингибиторы), или соединяются с неактивной частью и тем самым меняют химическую природу фермента (катализ нарушается) (неконкурентные ингибиторы – ионы тяжелых металлов – свинец, медь, ртуть, мышьяк и многие яды).
Регуляторная функция:
Поскольку практически все реакции в клетке катализируются ферментами, регуляция метаболизма сводится к регуляции интенсивности ферментативных реакций. Скорость последних может регулироваться двумя основными способами: путем изменения количества ферментов и/или изменения их активности, т. с. степени использования их каталитического потенциала. Факторы, регулирующие активность ферментов, разнообразны по своей природе . Физические факторы (температура, давление, свет, магнитное поле, электрические импульсы оказывают менее специфическое действие, чем химические.
33. Классификация ферментов. Классы ферментов, их характеристика.
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название EС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом: • EC 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа • EC 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. • EC 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза • EC 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. • EC 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. • EC 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.

34. . Современная теория биологического окисления, сопряженного с синтезом АТФ.
Окисление биологическое-совокупность реакций окисления, протекающих во всех живых клетках. Основная функция О. б. — обеспечение организма энергией в доступной для использования форме. Реакции О. б. в клетках катализируют ферменты, объединяемые в класс оксидоредуктаз. Изучение окисления в организме было начато в 18 в. А.Лавуазье;
Основной путь использования энергии, освобождающейся при О. б., — накопление её в молекулах аденозинтрифосфорной кислоты (АТФ) и др. макроэргических соединений О. б., сопровождающееся синтезом АТФ из аденозиндифосфорной кислоты (АДФ) и неорганического фосфата, происходит приГликолизе, окислении α-кетоглутаровой кислоты и при переносе ВЭ в цепи окислительных (дыхательных) ферментов, обычно называют окислительным фосфорилированием
Согласно СОВРЕМЕННОЙ ТЕОРИИ БИООКИСЛЕНИЯ в нашем организме окисление
может происходить двумя способами:
1. Путем отнятия водорода от окисляемого субстрата: сюда относятся
МИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ и ВНЕМИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ ОКСИДАЗНОГО
ТИПА.
2. Путем присоединения кислорода к окисляемому субстрату - так
происходит внемитохондриальное ОКИСЛЕНИЕ ОКСИГЕНАЗНОГО ТИПА (старое
название - МИКРОСОМАЛЬНОЕ окисление).
МИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ (МтО).
Система митохондриального окисления - мультиферментная система,
постепенно транспортирующая протоны и электроны на кислород с
образованием молекулы воды. Все ферменты митохондриального окисления встроены во внутреннюю
мембрану митохондрий. Только первый переносчик протонов и электронов -
никотинамидная дегидрогеназа расположена в матриксе митохондрии. Этот
фермент отнимает водород от субстрата и передает его следующему
переносчику. Полный комплекс таких ферментов образует "дыхательный
ансамбль" («дыхательную цепь»), в пределах которого атомы водорода
отнимаются от субстрата, затем передаются последовательно от одного
переносчика к другому, и, наконец, передаются на кислород воздуха с
образованием воды.
Понятие о гормонах, их классификация, свойства и механизм действия.
Гормоны - это то, что делает нас особенным и непохожим на остальных. Они предопределяют наши физические и психические особенности. Вырастем мы высоким или не очень, полным или худым. Наши гормоны влияют на все аспекты нашей жизни - с момента зачатия и до самой смерти. Они будут влиять на наш рост, половое развитие, формирование наших желаний, на обмен веществ в организме, на крепость мышц, на остроту ума, поведение, даже на наш сон.
Гормоны – химические соединения, обладающие высокой биологической активностью и в малых количествах значительным физиологическим эффектом. Гормоны транспортируются кровью к органам и тканям, при этом лишь небольшая их часть циркулирует в свободном активном виде. Основная часть находится в крови в связанной форме в виде обратимых комплексов с белками плазмы крови и форменными элементами. Эти две формы находятся в равновесии друг с другом, причем равновесие в состоянии покоя значительно сдвинуто в сторону обратимых комплексов. Их концентрация составляет 80 %, а иногда и более от суммарной концентрации данного гормона в крови.
Гормоны следует классифицировать по трем основным признакам.
1. По химической природе
2. По эффекту (знаку действия) – возбуждающие и тормозящие.
3. По месту действия на органы – мишени или другие железы: 1) эффекторные; 2) тропные.
В настоящее время описано и выделено более полутора сотен гормонов из разных многоклеточных организмов.
По химической природе гормоны разделены на три группы:
1) стероиды;
2) полипептиды и белки с наличием углеводного компонента и без него;
3) аминокислоты и их производные.
Для всех гормонов характерен относительно небольшой период полужизни – около 30 мин. Гормоны должны постоянно синтезироваться и секретироваться, действовать быстро и с большой скоростью инактивироваться. Только в этом случае они могут эффективно работать в качестве регуляторов.
Физиологическая роль желез внутренней секреции связана с их влиянием на механизмы регуляции и интеграции, адаптации, поддержания постоянства внутренней среды организма.
Свойства гормонов, механизм их действия
Выделяют три основных свойства гормонов:
1) дистантный характер действия (органы и системы, на которые действует гормон, расположены далеко от места его образования);
2) строгую специфичность действия (ответные реакции на действие гормона строго специфичны и не могут быть вызваны другими биологически активными агентами);
3) высокую биологическая активность (гормоны вырабатываются железами в малых количествах, эффективны в очень небольших концентрациях, небольшая часть гормонов циркулирует в крови в свободном активном состоянии).
Действие гормона на функции организма осуществляется двумя основными механизмами: через нервную систему и гуморально, непосредственно на органы и ткани.
Гормоны функционируют как химические посредники, переносящие информацию или сигнал в определенное место – клетку-мишень, которая имеет высокоспециализированный белковый рецептор, с которым связывается гормон.
По механизму воздействия клеток с гормонами гормоны делятся на два типа.
Первый тип (стероиды, тиреоидные гормоны) – гормоны относительно легко проникают внутрь клетки через плазматические мембраны и не требуют действия посредника (медиатора).
Второй тип – плохо проникают внутрь клетки, действуют с ее поверхности, требуют присутствия медиатора, их характерная особенность – быстровозникающие ответы.
В соответствии с двумя типами гормонов выделяют и два типа гормональной рецепции: внутриклеточный (рецепторный аппарат локализован внутри клетки), мембранный (контактный) – на ее наружной поверхности. Клеточные рецепторы – особые участки мембраны клетки, которые образуют с гормоном специфические комплексы. Рецепторы имеют определенные свойства, такие как:
1) высокое сродство к определенному гормону;
2) избирательность;
3) ограниченная емкость к гормону;
4) специфичность локализации в ткани.
Механизм действия гормонов с клеткой-мишенью происходит следующие этапы:
1) образование комплекса «гормон—рецептор» на поверхности мембраны;
2) активацию мембранной аденилциклазы;
3) образование цАМФ из АТФ у внутренней поверхности мембраны;
4) образование комплекса «цАМФ—рецептор»;
5) активацию каталитической протеинкиназы с диссоциацией фермента на отдельные единицы, что ведет к фосфорилированию белков, стимуляции процессов синтеза белка, РНК в ядре, распада гликогена;
6) инактивацию гормона, цАМФ и рецептора.
Действие гормона может осуществляться и более сложным путем при участии нервной системы. Гормоны воздействуют на интерорецепторы, которые обладают специфической чувствительностью (хеморецепторы стенок кровеносных сосудов). Это начало рефлекторной реакции, которая изменяет функциональное состояние нервных центров. Рефлекторные дуги замыкаются в различных отделах центральной нервной системы.
Выделяют четыре типа воздействия гормонов на организм:
1) метаболическое воздействие – влияние на обмен веществ;
2) морфогенетическое воздействие – стимуляция образования, дифференциации, роста и метаморфозы;
3) пусковое воздействие – влияние на деятельность эффекторов;
4) корригирующее воздействие – изменение интенсивности деятельности органов или всего организма.
