
- •Введение
- •Клетки животных in vitro
- •Историческая справка Основные вехи развития методологии культивирования клеток
- •Работы на культурах клеток удостоенные Нобелевские премии по физиологии или медицине:
- •Организация культуральной лаборатории
- •Помещение.
- •Оборудование
- •Правила работы персонала.
- •Культуральная посуда и расходные материалы
- •Методы стерилизации и дезинфекции
- •Техника безопасности при работе с культурами клеток
Организация культуральной лаборатории
__________________________________________________________________
Помещение.
Первое правило организации культуральных работ – стерильность, и все подходы к организации лаборатории для работы с клеточными культурами проводятся с обязательной оглядкой на это условие.
Как правило, лаборатория культивирования клеток состоит минимум из трех смежных помещений. Это собственно культуральная комната («бокс» или «чистая комната»), предбоксник и лаборатория общего назначения. Кроме того выделяется отдельное помещение подготовки персонала к ежедневной работе.
Культуральная комната (культуральный бокс или «чистая комната») – помещение в котором непосредственно проводятся все манипуляции с клетками. В этом помещении размещается все оборудование, «рабочий» запас реактивов и посуды, необходимых для работы с клеточными культурами. В культуральной комнате создаются и поддерживаются определенные внутренние условия, необходимые для работы с клетками. Одним из таких условий является обеспечение стерильности атмосферы, а также поддержание необходимых температуры и влажности.
Предбоксник (шлюз) – пустое небольшое помещение в котором отсутствует какое либо оборудование, служащее своего рода «буферной» зоной на пути входа в культуральный бокс, дополнительно ограничивающее пространство бокса от окружающей среды при входе и выходе персонала.
Лаборатория общего назначения – помещение, в котором проводятся исследовательские работы, для которых условие стерильности уже не является критичным, а также хранится запас реактивов и культуральной посуды.
Помещение подготовки персонала – зона в которой храниться чистая специальная одежда персонала для работы в боксе, в которой персонал передевается и проходит первичную антисептическую обработку. Очень часто функцию такого помещения выполняет отведенная зона в лаборатории общего назначения.
В идеале организация культуральной лаборатории должна начинаться еще при проектировке здания научно-исследовательской организации. В действительности же, чаще всего, исследователю приходиться подстраивать под свои потребности уже существующие, выделенные под лабораторию помещения. Да и в целом, подход к организации научно-исследовательской культуральной или биотехнологической лаборатории более гибкий, чем подход к организации «чистых помещений» на производстве фармацевтического или биотехнологического профиля. Существуют очень жесткие международные стандарты организации таких помещений на предприятиях, сведенные в так называемых правилах GMP (Good Manufacturing Practice) [ ].
В дальнейшем мы будем рассматривать правила подходы к работе в культуральной лаборатории научно-исследовательского профиля.
Оборудование
Ламинарный шкаф (Ламинарный бокс, Ламинар, Laminar-flow box), или боксы абактериальной воздушной среды (БАВ) обеспечивают физическую изоляцию рабочего места от окружающей среды. Технически это достигается путем постоянного равномерного (ламинарного) обдува рабочего места стерильным воздухом. Воздух забирается из окружающей среды или из рабочей камеры ламинара и фильтруется последовательно сначала через фильтры грубой очистки (табл…), а затем, через фильтры тонкой фильтрации – так называемые HEPA-фильтры.
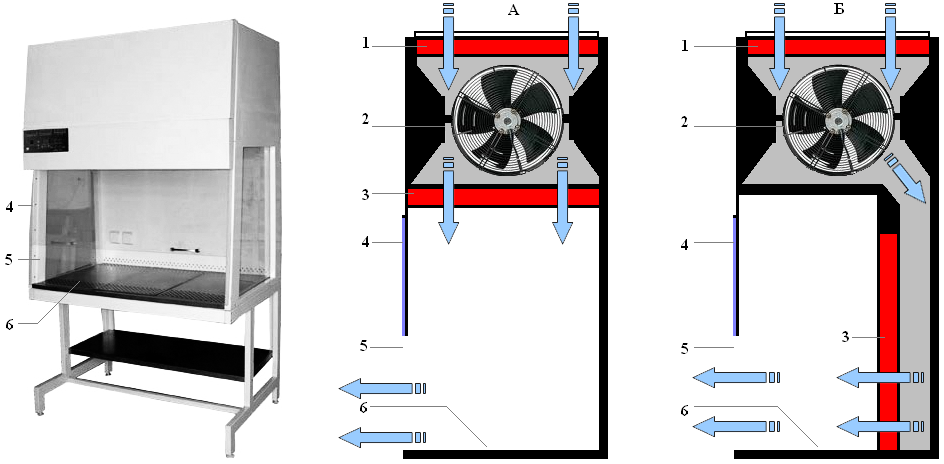
Рис. …. Устройство и принцип работы ламинарного бокса с вертикальной (А) и горизонтальной (Б) подачей очищенного воздуха.
1 – воздухозаборник с фильтром грубой (предварительной) очистки; 2 – вентилятор; 3 – фильтры тонкой (HEPA) очистки; 4 – закрытая рабочая зона; 5 – открытая рабочая зона; 6 – рабочая поверхность.
HEPA (англ. High Efficiency Particulate Air или High Efficiency Particulate Absorbing — высокоэффективное удержание частиц) — вид воздушных фильтров тонкой очистки. Фильтры такого типа были изобретены в 40х годах, во время развития ядерного проекта США. Использовались для улавливания радиоактивных частиц на предприятиях ядерной промышленности. Фильтр изготавливается из волокнистого материала, часто из фторопласта (диаметр волокон 0.65-6.5 микрон, расстояние между ними 10-40 микрон), сложенного гармошкой, а также корпуса с элементами, удерживающими лист в сложенном состоянии. Согласно принятой международной классификации существует 5 классов HEPA фильтров: Н10, Н11, Н12, Н13 и Н14. Чем выше класс, тем лучше качество фильтрации воздуха (табл…). Такой фильтр требует замены примерно 1 раз в год (в зависимости от загрязненности помещения). Еще более совершенными по сравнению с НЕРА, являются фильтры UPLA (Ultra Low Penetrating Air).
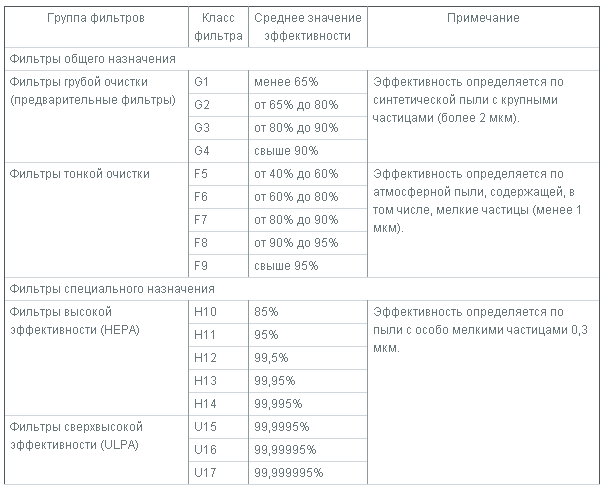
При выборе ламинарного бокса биологической безопасности в первую очередь следует ориентироваться на то, какой тип защиты необходим в планируемой работе (Табл…..), что необходимо защитить – продукт, оператора, окружающую среду, или все вместе.

CO2-Инкубатор. В связи с необходимостью поддержания постоянного рН питательной среды и ее минимального испарения в период инкубации клеток были созданы так называемые углекислотные инкубаторы. Основные конструкции и параметры полностью соответствуют обычным лабораторным термостатам. Основным отличием является наличие систем создания и поддержания определенного состава газовой среды внутри камеры термостата и высокой относительной влажности в ней. Инкубаторы для культивирования клеток должны отвечать определенным требованиям: обеспечивать высокую стабильность заданной температуры, создавать минимальный градиент температуры по полезному объему, иметь систему быстрого восстановления температуры после кратковременного охлаждения. Внутренняя поверхность термостатов должна быть изготовлена из биологически пассивных материалов, т.е. не влияющих на жизнедеятельность клеток и стойких к воздействию компонентов питательных сред. Материалы, из которых изготавливают внутренние и наружные части термостата, и покрытия должны выдерживать деконтамиацию водными растворами спирта и стерилизацию УФ-излучением.
В газовой среде камер углекислотного инкубатора повышена концентрация кислорода и углекислого газа, в большинстве случаев только углекислого газа; концентрацию задают в зависимости от условий культивирования и поддерживают автоматически с точностью до ±0,1 %. Наиболее распространены инфракрасные датчики CO2. Современные модели инкубаторов являются мультигазовыми, т.е. позволяют моделировать газовую среду путем подключения несколько газов одновременно.
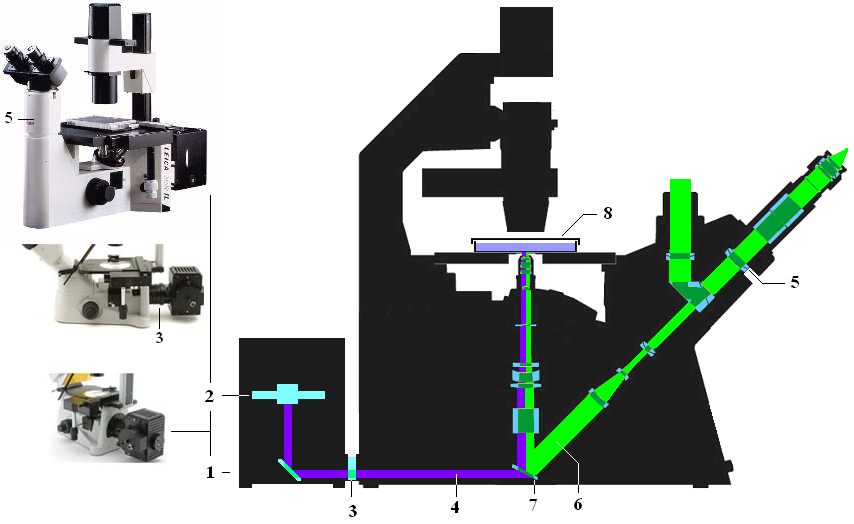
Оборудование для микроскопии. Для наблюдения за состоянием культивируемых клеток используются специальные перевернутые (инвертированные) микроскопы. Принцип инвертированности заключается в том, что объект наблюдения освещается сверху, а наблюдение ведется через объективы, расположенные под объектом. Это позволяет наблюдать за живыми клетками в культуре, т.е. непосредственно в, сосудах, где происходит процесс их роста. В микроскопах с обычной (прямой) оптической схемой навести фокус на объект исследования (клетки) невозможно из-за толщины культурального сосуда.
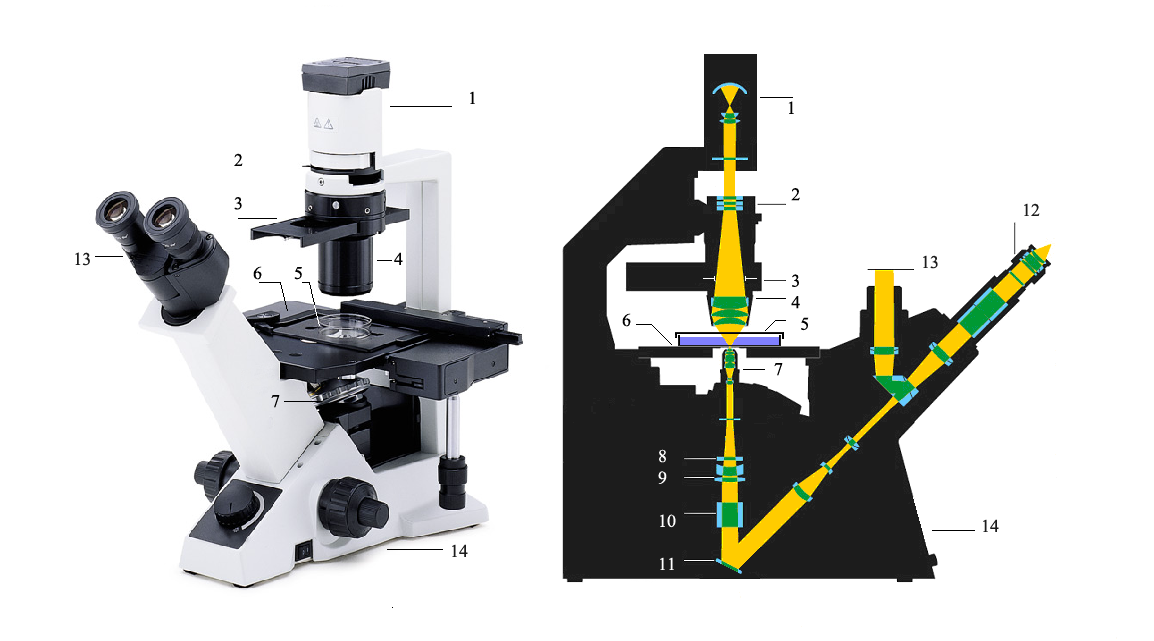
Общий вид и оптическая схема инвертированного микроскопа:
1- источник света (обычно галогеновая лампа ) с отражателем, 2- светофильтры, 3- диафрагма, 4- конденсор, 5- культуральный сосуд с клетками, 6- рабочий координатный стол, 7- насадка «револьверная» с окулярами, 8-11- направляющая система линз, 12- окуляры, 13- оптическая система вывода изображения на фото\видеокамеру, 14- база микроскопа.
Дополнительные устройства визуализации клеток в культуре.
Метод фазового контраста. Предназначен для получения изображений прозрачных и бесцветных объектов, невидимых при наблюдении по методу светлого поля. К таковым относятся, например, живые неокрашенные животные ткани. Суть метода в том, что даже при очень малых различиях в показателях преломления разных элементов препарата световая волна, проходящая через них, претерпевает разные изменения по фазе (приобретает т. н. фазовый рельеф). Получаемое таким образом изображение называется фазово-контрастным.
Устройство фазового контраста включает в себя специальные конденсор и набор объективов, которые устанавливаются вместо обычного на микроскоп.

Рис… Фазово-контрастный набор к световым микроскопам: 1- конденсор и объективы фазового контраста, 3- центрирующее устройство для настройки. Фото клеток по методу светлого поля (4) и фазового контраста (5).
Метод дает возможность различать малые элементы структуры, чрезвычайно слабо контрастные в методе светлого поля. Существуют различные модификации этого метода в основу которого заложены различные конструктивные изменения в строении оптической системы конденсора и объективов.
Устройство Варел-контраста (VAREL-contrast). Является модификацией метода фазового контраста. Контрастирование связано с изменением интенсивности света, прошедшего через объект, отличающийся по толщине от однородной среды. При движении объекта он освещается то с одной, то с другой стороны, что создает эффект косого освещения.
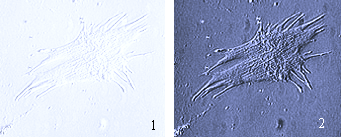
Рис… Фото клетки в проходящем свете (1) и с использованием метода Варел-контраста (2).
Устройства рельефного фазового контраста (Relief Phase Contrast – RPC):
Хоффман-контраст (Hoffman-contrast) - один из первых методов объемного изображения, позволяющих работать с объектами, находящимися в пластиковой посуде. Хоффмановский контраст позволяет создавать псеводорельефные изображения неокрашенных и двоякопреломляющих препаратов (например, живых клеток в пластиковых чашках для культивирования). Это метод косого освещения, повышающий контраст в окрашенных и неокрашенных препаратах. При методе Хоффмановского модуляционного контраста также отсутствует эффект гало, иногда наблюдаемый при работе по методу фазового контраста.
Разновидностью Хоффман-контраста является Интегрально-модуляционный контраст (Integrated Modulation Contrast – IMC).

Рис… Фото клеток в проходящем свете (1), по методу Хоффман-контраста (2) и IMC (3).
Дифференциально-интерференционный контраст (ДИК, DIC-contrast) - это дальнейшее развитие фазово-контрастного микроскопа. Для освещения объекта свет от источника предварительно поляризуется ( ) до объектива. Создается эффект объемности за счет различий в интенсивностях освещенности деталей в конечном изображении. С помощью данного метода получается монохроматическое оттененное изображение.
ПласДИК (PlasDIC) – модификация ДИК-контраста. В отличие от классического ДИК-контраста, поляризация света происходит после объектива в световом потоке, строящем изображение, т.е. после пластиковой посуды (объекта). Таким образом удается избежать цветных искажений.
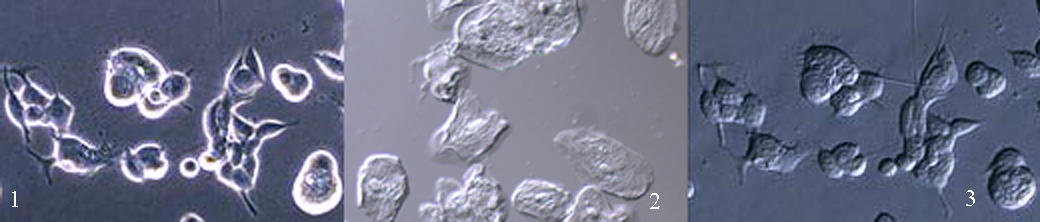
Рис… Фото клеток по методу классического фазового контраста (1), ДИК-контраста (2), ПласДИК-контраста (3).
Метод флуоресцентной микроскопии. Флуоресцентная (люминесцентная) микроскопия основана на способности некоторых веществ (флуорохромов) люминесцировать, т. е. светиться при освещении их светом (возбуждение) с определенной длиной волны. Цвет (длина волны) люминесценции смещен в более длинноволновую часть спектра по сравнению с возбуждающим ее светом (правило Стокса). Прикрепляя различными методами флуорохромы к биологическим молекулам можно заставить их светиться в определенном диапазоне спектра, визуализировать их, а анализируя спектр свечения определять их функциональное состояние, концентрацию и т.д.
Устройство флуоресцентного микроскопа отличаются от обычного светового микроскопа в основном следующим (Cм. Рис…):
1. Наличие мощного источника света в осветителе (1), излучающего преимущественно в коротковолновой (ультрафиолетовой, синей) части спектра - ртутно-кварцевая лампа или галогенная кварцевая лампа (2).
2. Наличие системы светофильтров: возбуждающие светофильтры (3) пропускают только ту часть спектра, которая возбуждает люминесценцию (4); "запирающие" светофильтры (5) расположены между окуляром. Эти светофильтры поглощают возбуждающее излучение (4) и пропускают свет люминесценции (6) от препарата к глазу наблюдателя.
Важную роль при этом способе освещения играет специальная интерференционная светоделительная пластинка (7), направляющая свет в объектив и на объект исследования (8). Она представляет собой полупрозрачное зеркало, которое избирательно отражает и направляет в объектив часть спектра, которая возбуждает люминесценцию (4), а пропускает в окуляр свет люминесценции (6).
Оптика объективов флуоресцентного микроскопа изготавливается из нелюминесцирующих сортов оптического стекла, часто кварца, и склеивается специальным нелюминесцирующим клеем. При работе с объективами масляной иммерсии используется нелюминесцирующее иммерсионное масло.
Применение флуоресцентной микроскопии:
Изучение морфологии клеток – за счет высокого контраста цветного изображения.
Первичное выявление и подсчет живых и мертвых клеток. Основано на способности ДНК к флуоресценции при связывании с специфическими красителями, причем спектр люминесценции будет зависеть от структурно-функционального состояния ДНК.
Визуализация и исследование клеточных микроструктур и макромолекул. Существует три принципа окрашивания клеточных микроструктур в зависимости от задач исследования. Первый – окрашивание флуоресцирующими красителями после фиксации клетки. Второй – окрашивание после фиксации клетки специфическими антителами конъюгированными с красителем. Третий – встраивание в геном клетки модифицированного гена (вектора) ответственного за выработку изучаемого продукта, белка, например. Причем ген модифицирован так, что клетка будет производить белок обладающий способностью к флуоресценции. В отличии от первых двух методов, третий способ позволяет наблюдать динамику изменений экспрессии генов изучаемого белка, например, его концентрации в режиме реального времени без фиксации препарата.
Цитохимическая индикация функциональных параметров клеток – встраивание в мембрану или внутриклеточные органеллы клетки флуоресцентной метки, которая будет менять интенсивность или спектр флуоресценции в ответ на изменение физиолого-биохимических параметров вне- или внутри клетки. Например, на изменение внутриклеточного рН.
Разновидностью флуоресцентной микроскопии является конфокальная микроскопия. Конфокальный микроскоп отличается от "классического" оптического микроскопа тем, что в каждый момент времени регистрируется изображение одной точки объекта, а полноценное изображение строится путем сканирования последовательно всех точек объекта. Для этого в качестве осветителя объекта используется лазерный луч. Использование лазерных лучей с различными длинами волн возбуждения сопрягает конфокальную микроскопию с классической люминесцентной. Качественно понятно, что применение конфокальной схемы должно приводить к увеличению контрастности изображения, за счет того, что "паразитный" свет от точек соседних с анализируемой перестает попадать в детектор. Наиболее часто встречающейся задачей для конфокальной микроскопии, благодаря ее высокому разрешению и контрасту, является изучение структуры клеток и их органелл, например, цитоскелета, ЭПР, лизосом, митохондрий, ядра, хромосом и даже генов. Исследуется также cо-локализация в клетке двух и более веществ. Еще одна задача – исследование динамических процессов, происходящих в живых клетках. Например, клеточного транспорта биологически-активных соединений. Записав в памяти компьютера серию оптических срезов, можно провести объемную реконструкцию объекта и получить его трехмерное изображение, не используя трудоемкую методику изготовления и фотографирования серийных гистологических срезов.
Метод электронной микроскопии. Электронная микроскопия - метод исследования микроструктуры твердых тел, их локального состава и микрополей (электрических, магнитных и др.) с помощью электронных микроскопов - приборов, в которых для получения увеличенных изображений используют электронный пучок. Различают два главных направления электронной микроскопии: трансмиссионную (просвечивающую) и растровую (сканирующую). Они дают качественно различную информацию об объекте исследования и часто применяются совместно.
Трансмиссионная микроскопия реализуется с помощью трансмиссионных (просвечивающих) электронных микроскопов (ТЭМ), в которых тонкопленочный объект просвечивается пучком ускоренных электронов с энергией 50-200 кэВ. Электроны, отклоненные атомами объекта на малые углы и прошедшие сквозь него с небольшими энергетическими потерями, попадают в систему магнитных линз, которые формируют на люминесцентном экране (и на фотопленке) светлопольное изображение внутренней структуры. При этом удается достичь разрешения порядка 0,1 нм, что соответствует увеличениям до 1,5 х 106 раз. Рассеянные электроны задерживаются диафрагмами, от диаметра которых в значит, степени зависит контраст изображения. При изучении сильнорассеивающих объектов более информативны темнопольные изображения.
В растровых электронных микроскопах электронный луч, сжатый магнитными линзами в тонкий (1-10 нм) зонд, сканирует поверхность образца, формируя на ней растр из нескольких тысяч параллельных линий. Возникающее при электронной бомбардировке поверхности вторичные излучения (вторичная эмиссия электронов) регистрируются различными детекторами и преобразуются в видеосигналы. Преимуществом сканирующей электронной микроскопии является возможность получения высококонтрастных объемных изображений.
При исследовании тонких пленок (в т.ч. монослоя клеток) повышают их контраст обработкой соединениями тяжелых металлов (Os, U, Pb и др.), которые избирательно взаимодействуют с компонентами микроструктуры (химическое контрастирование).
Атомно-силовая микроскопия. Атомно-силовой микроскоп (АСМ, AFM — atomic-force microscope) — сканирующий зондовый микроскоп высокого разрешения, основанный на взаимодействии специального механического зонда (кантилевера) с поверхностью исследуемого образца. Взаимодействие зонда с поверхностью образца обуславливается притяжением или отталкиванием зонда, вызванные силами Ван-дер-Ваальса. Атомно-силовой микроскоп способен измерять рельеф образца, погружённого в жидкость, что позволяет работать с органическими молекулами, включая ДНК. В отличие от растровой электронной микроскопии, который даёт псевдотрёхмерное изображение поверхности образца, АСМ позволяет получить истинно трёхмерный рельеф поверхности. Кроме того, возможность исследовать методом АСМ непроводящие поверхности, не требует нанесения проводящего металлического покрытия, которое часто приводит к заметной деформации поверхности. Для нормальной работы электронного микроскопа требуется вакуум, в то время как большинство режимов АСМ могут быть реализованы на воздухе или даже в жидкости. Данное обстоятельство открывает возможность изучения биомакромолекул и живых клеток.
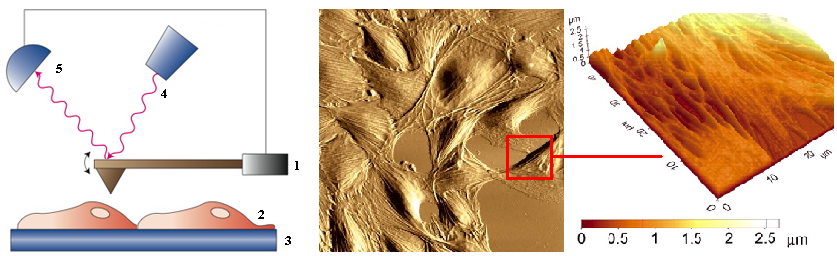
Зонд-игла (1) «плавает» по поверхности клетки на субстрате (2-3) на уровне Ван-дер-Ваальсовых сил притяжения-отталкивания. Перемещения зонда регистрируется по отклонению луча лазера (4) регистрируемое фотоприемником (5). В результате получается объемное, трехмерное изображение поверхности клетки.
