
- •4) Классификации аминокислот.
- •5) Физико-химические свойства белка. Обратимое и необратимое осаждение белка.
- •6) Этапы денатурации и ренатурации белков.
- •44. Холестерин и его производные: строение, свойства и функции.
- •46. Простагландины, их биологическая роль.
- •48.Структура ц-амф, биологическая роль. Регуляция содержания цАмф в клетках.
- •59. Витаминоподобные вещества: строение, свойства и функции в организме.
1.Биохимия . Предмет, цели и задачи . Биохимические методы анализа
1. Биологическая химия (биохимия) — наука о химическом составе и свойствах веществ живых организмов, о превращениях веществ в процессе жизнедеятельности. Совокупность этих превращений, отражающих постоянную взаимосвязь организма с внешней средой, принято называть обменом веществ.
Значение биохимии как науки для человеческого общества определяется тем, что она является одной из теоретических основ медицины, сельского хозяйства, биотехнологии, генетической инженерии и ряда отраслей промышленности, лесного дела.
Биохимию принято делить на статическую и динамическую. Задача статической биохимии — изучение химического состава и свойств веществ живых организмов.
Динамическая биохимия изучает превращения веществ в процессе жизнедеятельности или течение химических процессов в живой материи.
Методы биохимии.
Метод синтеза - способ соединения аминокислот друг с другом (пептидные связи) в молекулах белка и затем выяснить последовательность расположения аминокислотных остатков в полипептидных цепях белковых молекул.
Методу радиоактивных изотопов -дает возможность проследить за перемещением того или иного вещества в организме.
С помощью электронного микроокопа при очень сильном увеличении удалось изучить строение клеток, выявить в них наличие субклеточных образований
физические методы - метод рентгеноструктурного анализа, при помощи которого выявлена структура сложных соединений
Физико-химические методы позволили выяснить основные принципы построения биополимеров - белков, нуклеиновых кислот и полисахаридов, а познание молекулярного строения живого позволяет глубоко проникнуть в тайны жизненных процессов.
2.Строение и физико-химические свойства природных аминокислот.
Строение и свойства аминокислот
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же ?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
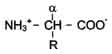
В водных растворах при нейтральном значении рН - аминокислоты существуют в виде биполярных ионов.
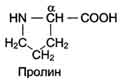
В отличие от 19 остальных ?-аминокислот, пролин - аминокислота, радикал которой связан как с ?-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в ?-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного ?-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
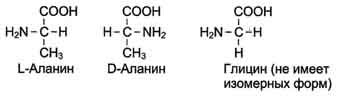
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментатив-но превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к ?-углеродному атому.
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические.
Алифатические аминокислоты.
Они составляют наиболее многочисленную группу. В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют • нейтральные аминокислоты — одна NН2 и одна СООН группы; • основные аминокислоты — две NН2 и одна СООН группы; • кислые аминокислоты — одна NН2 и две СООН группы.
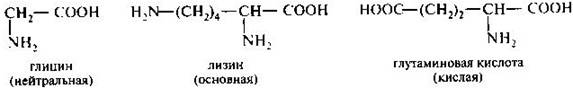
В алифатическом радикале могут содержаться дополнительные функциональные группы: • гидроксильная — серин, треонин; • карбоксильная — аспарагиновая и глутаминовая кислоты; • тиольная — цистеин; • амидная — аспарагин, глутамин.
Ароматические и гетероциклические аминокислоты. Эти аминокислоты построены таким образом, что бензольные и гетероциклические кольца в них отделены от общего аминокислотного фрагмента метиленовой группой —СН2—.
3.Стереоизомерия и амфотерность аминокислот.
Стереоизомерия. Принцип построения аминокислот, т. е. нахождение у одного и того же атома углерода двух различных функциональных групп, радикала и атома водорода, уже сам по себе предопределяет хиральность альфа-атома углерода. Исключение составляет простейшая аминокислота глицин Н2N-СН2-СООН, не имеющая углеводородного радикала R и соответственно центра хиральности.
Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные аминокислоты принадлежат к L-ряду.

Изолейцин, треонин, 4—гидроксипролин — содержат в молекуле по два центра хиральности. Эти аминокислоты могут существовать в виде четырех диастереомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Из этих четырех стереоизомеров для построения белков человеческого организма используется только один.
Амфотерность аминокислот обусловлена наличием в их молекулах функциональных групп кислотного (СООН) и основного (NН2) характера. Поэтому аминокислоты образуют соли как со щелочами, так и с кислотами.
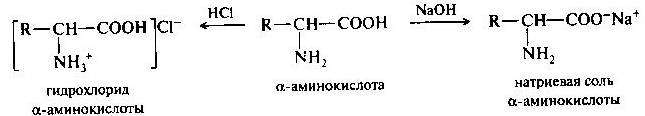
В твердом состоянии аминокислоты существуют в виде биполярных ионов; в водном растворе — в виде равновесной смеси биполярного иона, катионной и анионной форм. Положение равновесия зависит от рН среды. Общим для всех аминокислот является преобладание катионных форм в сильнокислых (pH 1—2) и анионных — в сильнощелочных (рH 13— 14) средах.
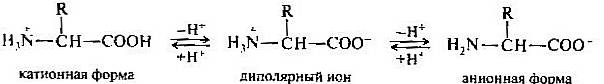
Ионное строение обусловливает некоторые особенности аминокислот: высокую температуру плавления (выше 200С), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях. Полностью протонированная аминокислота (катионная форма) с позиций теории Брёнстеда является двухосновной кислотой, содержащей две кислотные группы: недиссоциированную карбоксильную группу и протонированную аминогруппу, характеризующиеся соответствующими значениями рКа. Отдавая один протон, такая двухосновная кислота превращается в слабую одноосновную кислоту — биполярный нон с одной кислотной NН3-грулпой. Депротонирование биполярного нона приводит к получению анионной формы аминокислоты — ацилат-иону, являющемуся основанием Брёнстеда.
4) Классификации аминокислот.
Все
встречающиеся в природе аминокислоты
обладают общим свойством – амфотерностью
т.е. каждая аминокислота содержит как
минимум одну кислотную и одну основную
группы. Общий тип строения α-аминокислот
может быть представлен в следующем
виде:
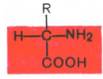 Как
видно из общей формулы, аминокислоты
будут отличаться друг от друга химической
природой радикала R, представляющего
группу атомов в молекуле аминокислоты,
связанную с α-углеродным атомом и не
участвующую в образовании пептидной
связи при синтезе белка. Почти все
α-амино- и α-карбоксильные группы
участвуют в образовании пептидных
связей белковой молекулы. Все разнообразие
особенностей структуры и функции
белковых молекул связано с химической
природой и физико-химическими свойствами
радикалов аминокислот. Именно благодаря
им белки наделены рядом уникальных
функций, не свойственных другим
биополимерам, и обладают химической
индивидуальностью. Часто классификация
основана на природе заряда аминокислоты.
Если радикал нейтральный (такие
аминокислоты содержат только одну
амино- и одну карбоксильную группы), то
они называются нейтральными аминокислотами.
Если аминокислота содержит избыток
амино- или карбоксильных групп, то она
называется соответственно основной
или кислой аминокислотой. Современная
рациональная классификация аминокислот
основана на полярности радикалов
(R-групп), т.е. способности их к взаимодействию
с водой при физиологических значениях
рН (близких к рН 7,0).
Как
видно из общей формулы, аминокислоты
будут отличаться друг от друга химической
природой радикала R, представляющего
группу атомов в молекуле аминокислоты,
связанную с α-углеродным атомом и не
участвующую в образовании пептидной
связи при синтезе белка. Почти все
α-амино- и α-карбоксильные группы
участвуют в образовании пептидных
связей белковой молекулы. Все разнообразие
особенностей структуры и функции
белковых молекул связано с химической
природой и физико-химическими свойствами
радикалов аминокислот. Именно благодаря
им белки наделены рядом уникальных
функций, не свойственных другим
биополимерам, и обладают химической
индивидуальностью. Часто классификация
основана на природе заряда аминокислоты.
Если радикал нейтральный (такие
аминокислоты содержат только одну
амино- и одну карбоксильную группы), то
они называются нейтральными аминокислотами.
Если аминокислота содержит избыток
амино- или карбоксильных групп, то она
называется соответственно основной
или кислой аминокислотой. Современная
рациональная классификация аминокислот
основана на полярности радикалов
(R-групп), т.е. способности их к взаимодействию
с водой при физиологических значениях
рН (близких к рН 7,0).
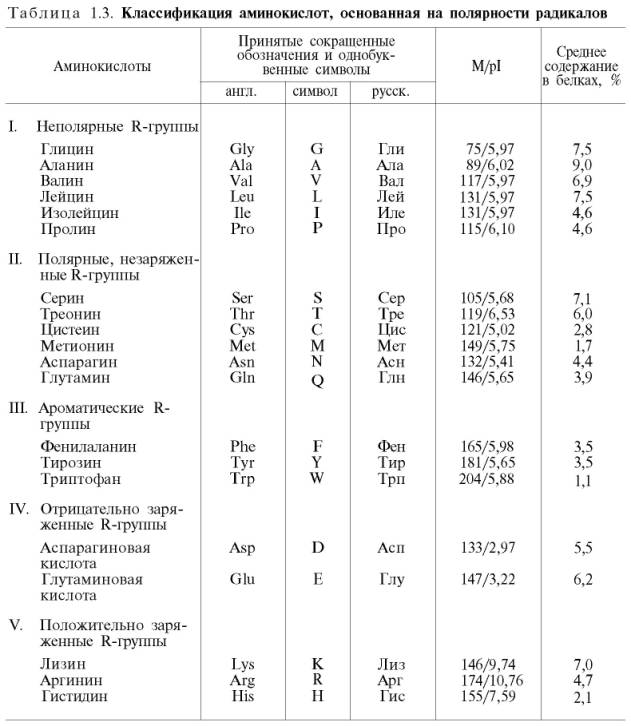
По функциональным группам
Алифатические
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин
По способности организма синтезировать из предшественников. 1)Незаменимые:Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин. 2)Заменимые:Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
5) Физико-химические свойства белка. Обратимое и необратимое осаждение белка.
Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков). Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза.
Белки обладают явно выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. С коллоидным состоянием белков связан ряд характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах микроскопии биологических объектов. Реакции осаждения белков. Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции.Обратимое осаждение. Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание. Высаливание. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция. Сущность реакции заключается в дегидратации молекул белка. Реактивы: 1) неразведенный яичный белок; 2) насыщенный раствор сульфата аммония; 3) NaOH, 10% раствор, 4) CuSO4, 1% раствор; 5) дистиллированная вода; 6) сульфат аммония в порошке. Ход определения. В пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция осаждается, а альбуминовая остается в растворе. Последнюю отфильтровывают, затем смешивают с порошком сульфата аммония до тех пор пока не прекратится растворение соли, при этом выпадает осадок - глобулины. Необратимое осаждение белков. Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
