
- •Опорні конспекти з хімії з теми № 2:
- •Насичені одноатомні спирти
- •Функціональна група кратний зв’язок радикали
- •Опорні конспекти з хімії з теми № 2:
- •Етиленгліколь, гліцерол – представники багатоатомних спиртів
- •Спирти, з декількома гідроксогрупами біля одного атому Карбону – нестійкі, самодозвільно вони перегруповуються в карбонільні сполуки. (Правило Ельтекова)
- •Етандіол
- •Пропантриол
- •Спирти: одноатомні двохатомні трьохатомні
- •Опорні конспекти з хімії з теми № 2:
кислотні
властивості ___________________
Спирти: одноатомні двохатомні трьохатомні
Фізичні властивості
за звичайних умов – безбарвні в’язкі рідини, солодкі на смак
tкип (етиленгліколю) =1980С
tкип (гліцеролу) = 2900С
добре розчиняється у воді, змішуються з водою в будь-яких співвідношеннях
етиленгліколь – дуже токсичний
Зверни увагу!:
tкип (багатоатомних спиртів) більше tкип (одноатомних спиртів)
(багатоатомних спиртів) більше (одноатомних спиртів)
Причини зростання , tкип багатоатомних спиртів, порівняно з одноатомними – більша кількість гідроксогруп більша кількість водневих зв’язків між молекулами спиртів більший ступінь асоціації молекул багатоатомних спиртів.
Хімічні властивості
Багатоатомні спирти проявляють всі властивості одноатомних спиртів, у взаємодії може брати одна або декілька гідроксогруп.
Кислотні властивості:
Водні розчини багатоатомних спиртів мають нейтральне середовище.
як одноатомні спирти реагують з лужними металами
СН2
– О – Н
СН2
– О – Na
+
2Na
+
H2 СН2
– О – Н
СН2
– О – Na
динатрій
етиленгліколят
в результаті
взаємодії етиленгліколю з металами
може утворюватись:
СН2
– О – Н СН2
– О –
Na натрій
етиленгліколят
на відміну від одноатомних спиртів
реагують активніше
СН2
– О – Н
СН2
– О – Na
2
СН – О – Н
+ 6 Na
2
СН – О – Na
+ 3
H2
СН2
– О – Н СН2
– О –
Na
тринатрій
гліцерат
в
результаті взаємодії гліцеролу з
металами можуть утворюватись:
СН2
– О – Н СН2
– О – Na
СН
– О – Н СН – О – Н
СН2
– О – Na
СН2
– О – Na
натрій гліцерат
динатрій гліцерат
на відміну від одноатомних спиртів багатоатомні спирти
реагують з купрум (ІІ) гідроксидом
Свіжоприготовлений блакитний осад купрум (ІІ) гідроксиду розчиняється в багатоатомних спиртах, утворюючи яскраво-синій розчин.
Якісна реакція на багатоатомні спирти
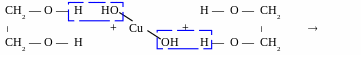
купрум
(ІІ) етиленгліколят
– комплекс
хелатного типу
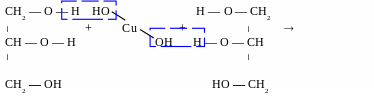

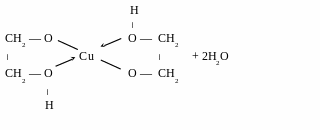
купрум
(ІІ) гліцерат
–
комплекс
хелатного типу
купрум
(ІІ) гліцерат
– комплекс хелатного типу
Реакції заміщення гідроксогупи галогеном - SN
Одна гідроксогрупа в молекулі етиленгліколя при дії HCl (к) заміщується на галоген, друга - заміщується важче, тільки під дією PCl5
СН2
– ОН
+HCl
СН2
– ОH
+PCl5
СН2
– Cl
СН2
– ОН
СН2
– Cl
СН2
– Cl
СН2
— ОН
+
HCl
СН2
— Cl
+
Н2О
СН2
— ОН
СН2
—ОH
2-хлороетанол
СН2
— Cl
СН2
— Cl
СН2
— ОН
+
РCl5
СН2
— Cl
+
POCl3
+
НCl
1,2-дихлороетан
В молекулі гліцеролу крайні гідроксогрупи при дії HCl (к) по черзі заміщуються на галоген, центральна – важко, тільки при дії PCl5
СН2
– ОН
СН2
–
Cl
СН2
–
Cl
СН2
–
Cl
+HCl
+HCl
+PCl5
СН
– ОН
СН – ОH
СН – ОH
СН – Cl
-H2O
-H2O
–POCl3
–HCl
СН2
– ОН СН2
– ОH
СН2
– Cl
СН2
– Cl
*Реакції дегідратації
реакції внутрішньомолекулярної дегідратації
для етиленгліколю [t0 > 1700, kat – H2SO4]
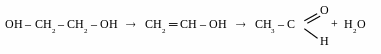
д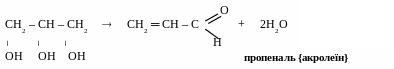 ля
гліцерину [t0
> 1700,
kat
– H2SO4
або
дія
вологовіднімаючих агентів – KHSO4,
MgSO4]
ля
гліцерину [t0
> 1700,
kat
– H2SO4
або
дія
вологовіднімаючих агентів – KHSO4,
MgSO4]
Реакції естерифікації
в
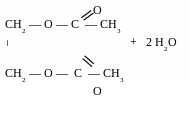 заємодія
з органічними кислотами призводить
до утворення
естерів
заємодія
з органічними кислотами призводить
до утворення
естерів
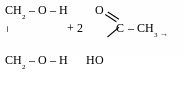
діацетат
етиленгліколю
триацетат
гліцеролу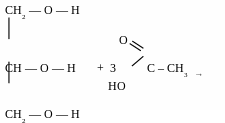
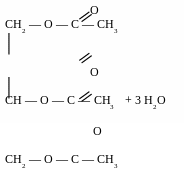
взаємодія з мінеральними кислотами призводить до утворення естерів
СН2
– О – Н
СН2
– О – NO2
+ 2Н
–
О – NO2
+
2H2O СН2
– О – Н
СН2
– О – NO2
динітрат етиленгліколю
СН2
– О – Н
СН2
– О – NO2
СН
– О – Н
+
3Н
–
О – NO2
СН – О – NO2
+
3H2O
СН2
– О – Н
СН2
– О –
NO2
тринітрат гліцеролу
За звичайних умов тринітрат гліцерону – рідина, чуттєва до удару, є вибуховим матеріалом.
Тринітрат гліцеролу {нітрогліцерин} - основний компонент динаміту.
4С3Н5(ONO2)3 12CO2 + 6N2 + 10H2O + O2 [t0вибуху = 30000С]
Динітрат етиленгліколю – вибухий матеріал меншої сили
С2Н4(ONO2)2 2CO2 + N2 + 2H2O
1% розчин тринітрату гліцерину – нітрогліцерин – серцеві ліки
Якісна реакція - дія купрум (ІІ) гідроксидом
Свіжоприготовлений осад Cu(OH)2 при додаванні до розчинів багатоатомних спиртів набуває яскраво-синього кольору, за рахунок утворення комплексних солей ( хімічні властивості )
Способи добування багатоатомних спиртів
Е
Ar
(СН2)n
ОН
Оксосинтез – із синтез-газу
[t0 2500, Р – 200МПа, kat – Fe(CO)5 ]
2СО + 3Н2 ОН – СН2 – СН2 – ОН
Гідроліз дихлороетану
[+ HOH, (OH-)]
Cl – СН2 – СН2 – Cl + 2HOH ОН – СН2 – СН2 – ОН + 2HCl
Гідратація оксиду етилену
[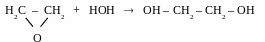 +
HOH,
(H+)]
+
HOH,
(H+)]
Нагадай! Оксид етилену отримують при каталітичному окисненні етену (kat – Ag) киснем повітря
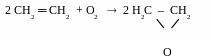
М’яке окиснення етилену - реакція Вагнера
СН2 ═ СН2 + 2 KMnO4 + 2 KOH ОН – СН2 – СН2 – ОН + 2 К2MnO4
: етен етиленгліколь
KMnO4 СН2
═
СН2
ОН
– СН2
– СН2
– ОН
: етен Х етиленгліколь
+Cl2
+KOH СН2
═
СН2
Cl
– СН2
– СН2
– Cl
ОН
– СН2
– СН2
– ОН
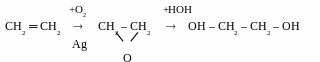
Г
Ar
(СН2)n
ОН
Оксосинтез – із синтез-газу
[t0 3500, Р – 250МПа, kat – Fe(CO)5 ]
3СО + 4Н2 ОН – СН2 – СНОН – СН2 – ОН
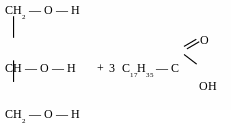 Гідроліз
жирів – омилення жирів
Гідроліз
жирів – омилення жирів
[ +
HOH, (OH-)]
+
HOH, (OH-)]
Синтези з пропілену – продукту перегонки нафти
синтез, що ґрунтується на термічному хлоруванні пропілену
+Cl2
, 5000C
+ NaOH, 1500C
+
HClO СН2
═
СН
– СН3
СН2
═
СН
– СН2Cl
СН2
═
СН
– СН2OH
-HCl
-NaCl
1
2
3
+
NaOH
(в
р-н)
СН2
– СН – СН2
СН2
– СН – СН2
-NaCl
3
Cl
OH
OH
4
OH
OH OH
тристеарин
Застосування етиленгліколю
як антифриз (рідина, яка зменшує температуру замерзання води)
сировина для добування диоксану – важливого розчинника естерів целюлози, (дуже токсичного!)

сировина у виробництві синтетичного волокна лавсан:
Лавсан отримують реакцією поліконденсації етиленгліколю та терефталевої кислоти.
Р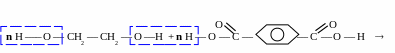
 еакції
поліконденсації
– реакція синтезу полімерної сполуки,
яка супроводжується утворенням
низькомолекулярного продукту (Н2О)
еакції
поліконденсації
– реакція синтезу полімерної сполуки,
яка супроводжується утворенням
низькомолекулярного продукту (Н2О)
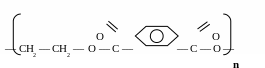
політерефталат етиленгліколю - лавсан
Застосування гліцеролу
поширений в природі - спирт, що бере участь в утворенні природних жирів
харчова промисловість – приготування безалкогольних напоїв
шкіряне виробництво, текстильна промисловість - пом’якшувач, надає еластичності
парфумерія, фармація – зволожувач шкіри
виробництво вибухівки - нітрогліцерину
Тренувальні вправи
Написати рівняння реакцій:
етиленгліколь + Na
гліцерол + Na
етиленгліколь + Cu(OH)2
гліцерол + Cu(OH)2
етиленгліколь + HCl
2-хлороетанол етиленгліколь
гліцерол + HCl
етиленгліколь 1,2-дихлороетан
гліцерол 1,2,3-трихлоропропан
етиленгліколь +HNO3
гліцерол + HNO3
етиленгліколь + оцтова кислота
гліцерол + оцтова кислота
етиленгліколь (t0 > 1700C, H2SO4)
гліцерол (t0 > 1700C, H2SO4)
етиленгліколь + О2
етилен Х етиленгліколь (2 способи)
1,2,4-трихлоробутан + калій гідроксид (водн.р-н)
етилен етиленгліколь
синтез-газ етиленгліколь
синтез-газ гліцерин
Написати рівняння реакції окиснення 2-бутену водним розчином калій перманганату. Скласти електронний баланс, визначити окисник, відновник.
Написати рівняння реакцій за допомогою яких з метану можна отримати етиленгліколь.
Написати рівняння реакцій за допомогою яких можна здійснити ланцюжки перетворень:
метан Х етен У 1,2-етандиол динітрат етиленгліколю азот
кальцій Х кальцій карбід У Z етиленгліколь повний калій гліколят
Тренувальні задачі
Який максимальний об’єм водню (н.у.) можна добути, якщо нагрівати суміш 1,38 г натрію та 1 моль гліцерилу.
При взаємодії натрію, взятого у надлишку із 95 г насиченого двохатомного спирту взятого у надлишку виділилось 1,25 моль водню. Визначити формулу спирту.
При спалюванні 1 моль спирту утворилось 2 моль вуглекислого газу. Який спирт було взято? Визначити формулу спирту? Чи має задача однозначний розв’язок?
Обчислити масову частку етиленгліколь у водному розчині, якщо молекул води в ньому в 10 разів більше, ніж молекул спирту.
На взаємодію суміші метанолу та етиленгліколю витратили 4,9 г купрум (ІІ) гідроксиду. При дії на таку саму кількість вихідної суміші калієм виділився газ, об’эмом 5,6 л. (н.у.) Визначити масову частку етиленгліколю у вихідній суміші.[39,2%]
При дії на етиленовий вуглеводень масою 39,2 г надлишком водного розчину калій перманганату додержали 63 г симетричного спирту. Визначити формулу вихідного вуглеводню. [2-бутен]
Визначити, чи вистачить 69 г натрію для повного заміщення атомів Гідрогену гідроксильних груп у гліцерині об’ємом 72,7 мл (густина 1,265 г/см3.
