
- •Опорні конспекти з хімії з теми № 2:
- •Насичені одноатомні спирти
- •Функціональна група кратний зв’язок радикали
- •Опорні конспекти з хімії з теми № 2:
- •Етиленгліколь, гліцерол – представники багатоатомних спиртів
- •Спирти, з декількома гідроксогрупами біля одного атому Карбону – нестійкі, самодозвільно вони перегруповуються в карбонільні сполуки. (Правило Ельтекова)
- •Етандіол
- •Пропантриол
- •Спирти: одноатомні двохатомні трьохатомні
- •Опорні конспекти з хімії з теми № 2:
Опорні конспекти з хімії з теми № 2:
Оксигеновмісні органічні речовини
Насичені одноатомні спирти
Уч__________ 11 - М класу
Хімічні елементи Оксиген, Нітроген, Сульфур входять до складу органічних сполук у вигляді функціональних груп. В таких речовинах вуглецевий радикал зв’язаний з функціональною групою.
Функціональна група – це атом або група атомів, які мають постійний склад, визначають властивості органічних сполук та їх приналежність до гомологічного ряду.
ГІДРОКСИСПОЛУКИ
OH гідроксогрупа {гідроксильна група} - функціональна група двох споріднених гомологічних рядів:
с
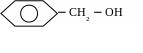 пиртів:
R
OH
пиртів:
R
OH
СН3 СН2 ОН
ф
 енолів:
Ar
OH
енолів:
Ar
OH
Спирти R OH
Спирти – похідні вуглеводнів, в молекулах яких один або декілька атомів Гідрогену заміщено на гідроксогрупи
Класифікація спиртів
Кількість гідроксогруп
одноатомні
СН3 СН2 СН2 ОН
двохатомні
НО СН2 СН2 СН2 ОН
т
СН2 СН СН2
ОН ОН ОН
рьохатомні
Характер вуглецевого радикалу
ациклічні, насичені
СН3 СН2 СН2 СН2 ОН
ациклічні, ненасичені
СН2 ═ СН СН2 СН2 ОН
ароматичні
Ar (СН2)n ОН
Місце гідроксогрупи у вуглецевому радикалі
первинні
СН3 СН2 СН2 СН2 ОН
в
СН3 СН СН2 СН3
ОН
торинніт
СН3
СН3 С СН2 СН3
ОН
ретинні
Номенклатура спиртів
(IUPAC) суфікс – ол
Головний ланцюг має містити найбільшу кількість атомів Карбону, а також включати атом Карбону, біля якого розміщена гідроксогрупа.
При нумерації головного ланцюга дотримуються принципу “старшинства”:
Функціональна група кратний зв’язок радикали
СН3 СН3
СН
СН2
СН
СН3
ОН ______________________________________
СН3 СН3
СН
СН
ОН
СН3
______________________________________
СН3
СН
СН3
ОН _________________________
_________________________
СН3
СН3
СН3
С
СН2
С
СН3
СН2
СН
ОН
СН3
СН3
______________________________
Замісникова
Назва спирту утворюється - назва R + иловий спирт
СН3 СН2 СН2 СН2 ОН
СН3 СН2 ОН
Насичені одноатомні спирти. Алканоли
Нагадай! Загальну формулу насичених вуглеводнів – алканів!
СnH2n+2
Так як насичені одноатомні спирти розглядають як похідні насичених вуглеводнів у яких один атом Гідрогену заміщено на гідроксогрупу
СnH2n+1OH або СnH2n+2O, n 1
n = 1: СН3ОН – метанол, метиловий спирт, {деревний спирт}
n = 2: С2Н5ОН – етанол, етиловий спирт, {винний спирт}
Ізомерія спиртів
ізомерія вуглецевого скелету
ізомерія положення функціональної групи
міжкласова ізомерія (насичені одноатомні спирти ізомерні етерам R O R)
СН4О – ізомерів не має
СН3ОН – метанол
С2Н6О – міжкласові ізомери
СН3 СН2 ОН етанол
СН3 О СН3
метоксиметан
Кількість ізомерів, які можуть утворювати насичені одноатомні спирти (без врахування між класової ізомерії):
С3Н8О - 2
С4Н10О - 4
С5Н12О – 8
Будова спиртів
Будова функціональної групи, а також взаємний вплив вуглецевого радикалу і атомів функціональної групи визначають будову органічної речовини.
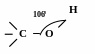
O -
_____ гібридизований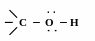
Т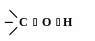 ак
як атом Оксигену більш електронегативний,
ніж атоми Карбону і Гідрогену, електронна
густина зв’язків
С
О та О
Н зміщена
до атому Оксигену.
ак
як атом Оксигену більш електронегативний,
ніж атоми Карбону і Гідрогену, електронна
густина зв’язків
С
О та О
Н зміщена
до атому Оксигену.
Зверни увагу! Полярність зв’язку О Н більша полярності зв’язку С О.
Фізичні властивості
за звичайних умов - безбарвні
С1 – С11 – рідини
С12 – тверді речовини
tкип (спиртів):
більше, ніж tкип (вуглеводнів з відповідною молекулярною масою)
tкип (спиртів) більше, ніж tкип (ізомерних етерів)
tкип (спиртів з розгалуженим скелетом) менше, ніж tкип (cпиртів з лінійною будовою).
спирти добре розчиняються у воді, при кількості атомів Карбону в молекулі, розчинність спиртів , а в органічних розчинниках
С1 – С3 – необмежено розчиняються у воді
С4 – С5 – розчинність обмежена
вищі спирти – нерозчинні у воді
запах спиртів
нижчі спирти мають алкогольний запах
третинні – сивушний
вищі – без запаху
фізіологічна дія – отрута, наркотична дія
СН3ОН – дуже сильна отрута {10 мл – сліпота, 30 мл – летальний кінець}
Аномальні фізичні властивості спиртів зумовлені:
Н а
фізичні властивості спиртів впливає
наявність в їх молекулах полярних
гідроксогруп.
а
фізичні властивості спиртів впливає
наявність в їх молекулах полярних
гідроксогруп.
За рахунок водневих зв’язків між рухливим атомом Гідрогену однієї гідроксогрупи та вільних електронних пар атому Оксигену сусідньої гідроксогрупи, молекули спиртів об’єднуються в асоціати
___________________________________________________________________
 ______________________________________________________________
______________________________________________________________
Розчинність спиртів у полярних і неполярних розчинниках залежить від того, яка частина загальної маси молекули спирту припадає на гідроксогрупу.
Нижчі спирти необмежено розчинні у воді через утворення водневих зв’язків між молекулами спирту та води.
Із підвищенням молекулярної маси зростає вуглеводнева – неполярна частина молекули і зменшується відносний вміст полярної частини молекули - гідроксогрупи. при кількості атомів Карбону в молекулах спиртів, їх розчинність у воді , а в органічних розчинниках .
Хімічні властивості спиртів
П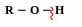 олярність
зв’язку О
Н зумовлює кислотні властивості спиртів.
олярність
зв’язку О
Н зумовлює кислотні властивості спиртів.
Кислотні властивості спиртів виражені так слабко, що спирти у водних розчинах не змінюють забарвлення індикаторів водні розчини спиртів – нейтральні.
Вплив замісників у молекулах спиртів на їх властивості
Замісники (+І)
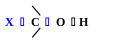 зменшується
полярність зв’язку
О
Н
спадають
кислотні властивості спиртів
зменшується
полярність зв’язку
О
Н
спадають
кислотні властивості спиртів
Всі вуглецеві радикали володіють позитивним індукційним ефектом R (+I) в рядах:
НОН
СН3ОН
СН3
– СН2
– ОН
СН3
– СН2
– СН2
– ОН
кислотні
властивості
___________________
Замісники (-І)

зростає
полярність зв’язку О
Н
зростають
кислотні властивості спиртів
зростає
полярність зв’язку О
Н
зростають
кислотні властивості спиртів
Hal (-I) володіють негативним індукційним ефектом в рядах:
СН3
–
СН2
– ОН
СН2Br
–
СН2
– ОН
СH2Cl
–
СН2
– ОН
кислотні
властивості
___________________
Cl
Cl
Cl
– СН2
– СН2
–
ОН
Cl
– СН – СН2
– ОН
Cl
– С – СН2
– ОН
Cl
кислотні
властивості
___________________
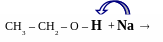 Кислотні
властивості спиртів –
підтверджуються їх взаємодією з лужними,
лужноземельними металами, Al.
Кислотні
властивості спиртів –
підтверджуються їх взаємодією з лужними,
лужноземельними металами, Al.
CH3 – OH + Al
CH3 – CH2 – ONa – натрій етилат
(CH3 – O)3Al - алюміній метилат
В
R – O – Me
алкоголяти
CH3 – CH2 – ONa + HOH CH3 – CH2 – OH + NaOH
Реакції заміщення гідроксогупи галогеном - SN
CH3 – CH2 – OH + HCl CH3 – CH2 – Cl + H2O
в пробірці:
CH3 – CH2 – OH + KCl + H2SO4 CH3 – CH2 – Cl + H2O + KHSO4
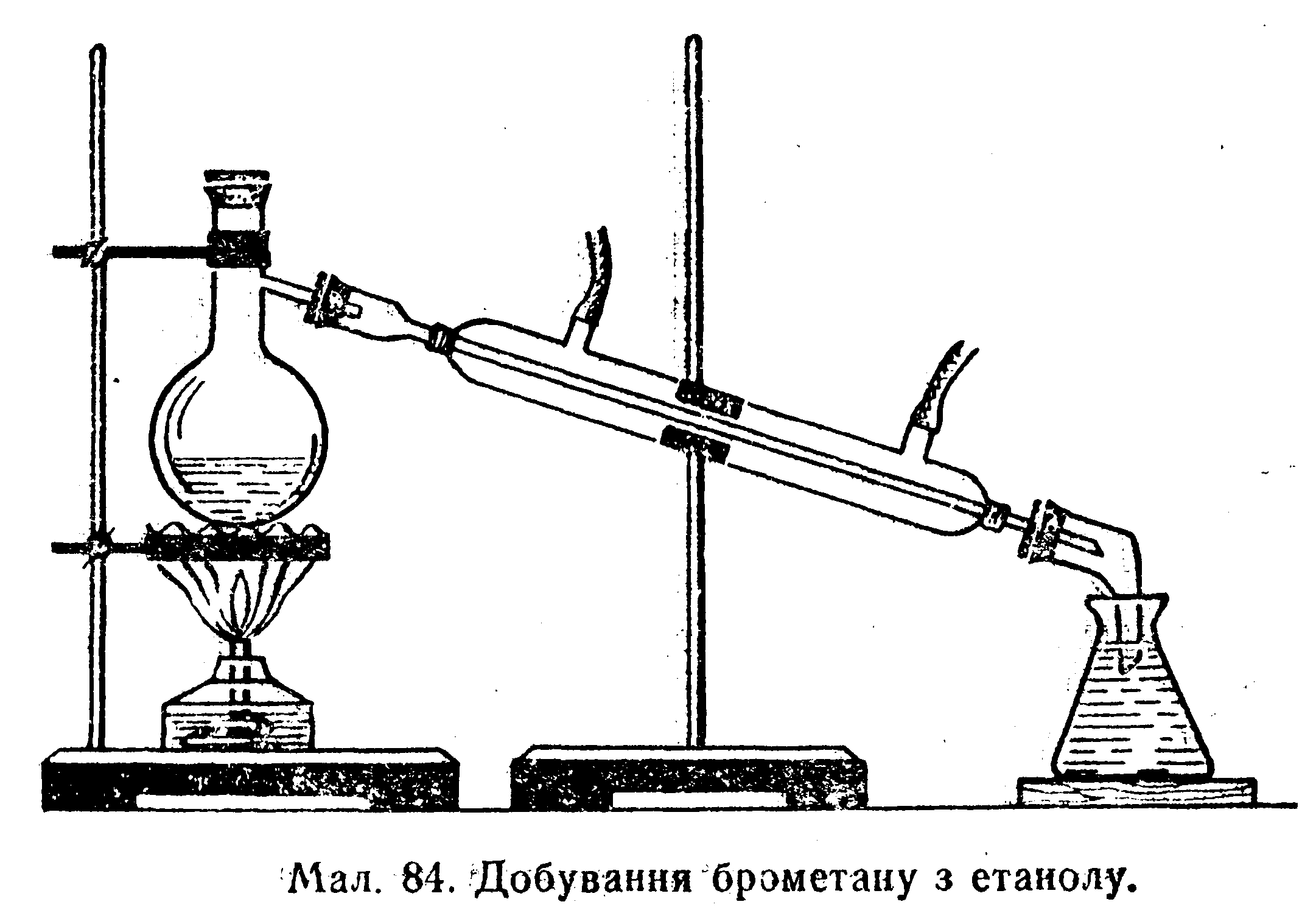
Реакції дегідратації
реакції внутрішньомолекулярної дегідратації
t0>170,
kat CH3
– CH2
– OH
t0>170,
kat CH3
– CH – CH2
– CH3
OH
{
Правило Зайцева}
Зверни увагу! Молекула води найлегше відщеплюється від молекул третинного спирту.
Зверни увагу! Спирт, який не може вступати в реакцію внутрішньо молекулярної дегідратації – це ___________________________
реакції міжмолекулярної дегідратації – реакції утворення етерів
[t0 < 1700, kat – H2SO4]
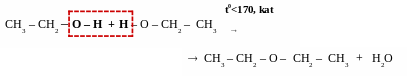
t0<170,
kat CH3
– CH – CH3
+ CH3
– CH – CH3
:
ОН
ОН
t0<170,
kat CH3
–
O
–
H
+ Н
–
О –
CH2
– CH3
:
ааа
ааа
ааа
Для добування одного несиметричного етеру проводять синтез Вільямсона – взаємодія галогенпохідних алканів з алкоголятами.
[ t0]
t0]
Реакції естерифікації (англ – ester – складний ефір) – реакції взаємодії спиртів з органічними або мінеральними кислотами, що призводять до утворення естерів.
 Зверни
увагу!:
Зверни
увагу!:
взаємодія з органічними кислотами
[t0, kat – H2SO4]
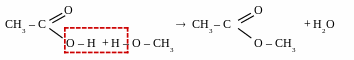
_______________________________________
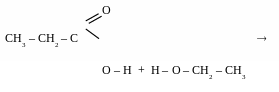
_______________________________________
_______________________________________
взаємодія з мінеральними кислотами
[t0, kat – H2SO4]
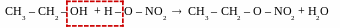
_______________________________________
_______________________________________
CH3
– CH2
– OH
+ Н
– О
–
SО3H
_______________________________________
_______________________________________
Реакції окиснення
реакції повного окиснення – горіння
Метанол та етанол горять синюватим полум’ям з виділенням великої кількості тепла.
СН4О + О2
С2Н6О + О2
реакції часткового окиснення
Продукти часткового окиснення спиртів залежать від:
положення гідроксогрупи у вуглецевому радикалі (первинні, вторинні, третинні)
сили окисника.
первинний спирти альдегід [[О] – CuO, t0]
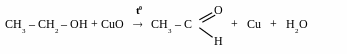
первинний спирт карбонова кислота
[[О] – KMnO4, K2Cr2O7, CrO3 (H+) ]
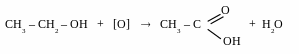
CH3 – CH2 – ОН + K2Cr2O7 + H2SO4
*** вторинний спирт кетон
CH3
– CH – CH3
+
[О]
CH3
– C – CH3
+ H2O
║ ОН
O
CH3
– CH – CH3
+
KMnO4
+ H2SO4
ОН
третинні спирти ≠
Окиснення третинних спиртів можливе при дії дуже сильних окисників і призведе до руйнування вуглецевого скелету з утворенням різних карбонових кислот та кетонів.
Якісна реакція на насичені одноатомні спирти
дія хромової суміші (K2Cr2O7 + H2SO4) на первинні та вторинні спирти.
Оранжево-червоний розчин хромової суміші при додаванні в розчин первинного або вторинного спирту набуває зеленого забарвлення.
дивись р.р. взаємодії етанолу та K2Cr2O7 в присутності H2SO4
Способи добування спиртів
Лужний гідроліз моногалогенпохідних вуглеводнів
CH3
– CH2
– Cl
+
NaOH
CH3
– CH2
– OH
+
NaCl
водний розчин
Нагадай! Взаємодія моногалогенпохідних вуглеводнів із спиртовим розчином лугу при t0 призводить до утворення __________________________
CH3
– CH – CH2
–
CH3
+
NaOH
спиртовий розчин Cl
{
Правило Зайцева}
Гідратація алкенів
Н3РО4,
H2SO4
CH2
═
CH – CH2
– CH3
+ H2O
{
Правило
Марковнікова}
Гідрування альдегідів та кетонів
альдегід первинний спирт [ t0, kat - Ni]

кетон вторинний спирт [ t0, kat - Ni]
t0
Ni R
– C – CH3
+
H2
R
– CH –
CH3 ║
О
ОН
Гідроліз естерів
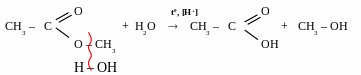
Синтол-процес - синтез спиртів із синтез-газу
[kat – Ме родини Fe, P – 1800-2500 кПа]
3СО + 6Н2 CH3 – CH2 – CH2 – OH + 2Н2О
Окремі представники спиртів
Метиловий спирт - метанол
Довгий час єдиним джерелом метанолу були продукти сухої перегонки деревини без доступу повітря деревний спирт
Сучасний спосіб добування – із синтез газу
[kat – Cr2O3, ZnO, t0 – 3000C, P – 20 MПа]
СО + 2Н2 СН3ОН
Метанол (tкип = 64,70С) необмежено змішується з водою, має слабкий запах алкоголю, що нагадує запах етанолу. Дуже токсичний!
Використовується для технічних потреб:
розчинник
сировина для добування формальдегіду.
Метанол – перспективне паливо для двигунів внутрішнього спалювання!
Е
Ar
(СН2)n
ОН
За обсягом виробництва етанол посідає одне з перших місць серед продуктів хімічної промисловості.
Етанол - безбарвна рідина (tкип = 78,30С) з характерним алкогольним запахом, необмежено розчиняється у воді, має дезинфікуючі властивості.
Має дуже сильну наркотичну дію. При концентрації етанолу в крові 5% - тяжке отруєння, можливий летальний кінець.
Ректифікацією можна отримати спирт 96% - спирт-ректифікат. Ректифікат застосовують для харчових та медичних потреб.
При зневодненні етилового спирту, застосовують водовідбирні засоби {CaO, P2O5, Mg, CaCl2} отримують абсолютний спирт. Абсолютний спирт дуже гігроскопічний.
Етанол для харчової і фармацевтичної промисловості отримують бродінням цукристих речовин:
крохмаль (картоплі або злакових) глюкоза етиловий спирт
дріжджі С6Н12О6
2С2Н5ОН
+ 2СО2
Етанол для технічних потреб добувають з нехарчової сировини:
целюлоза (відходи деревообробної промисловості) глюкоза етиловий спирт = гідролізний спирт
гідратація етилену – синтетичний спирт
[kat
H3PO4/алюмосилікат,
t0
– 3000C,
P] СН2
═ СН2
+ НOH
→ CH3
– CH2
– OH
Для запобігання вживання нехарчового спирту його денатурують бензеном, бензином, барвниками – спирт-денатурат.
Етанол застосовують:
для добування синтетичного каучуку
Нагадай! Реакція Лєбєдєва:
як розчинник
для синтезу оцтової кислоти
для виготовлення фармацевтичних препаратів. Етанол гарний екстрагент, застосовують для виготовлення настоянок.
як антисептик у медицині
етанол – добавка до бензину – паливо для двигунів внутрішнього спалювання.
Тренувальні вправи
Н
ОН СН3
СН3 СН СН2 СН СН2 СН3
ОН СН3
СН2 СН2 С СН СН3
СН3
азвати спирти за систематичною номенклатурою:
ААА
ААА
____________________________________________________________________________
СН3
СН3
СН
С
ОН
СН3
ААА
СН3
СН3
СН
С
ОН
СН2
СН3
ААА
____________________________________________________________________________
Визначити ізомери та гомологи серед речовин:
СН3 СН2 СН2 ОН
СН3 СН2 СН2 СН2 ОН
СН3 СН2 О СН2 СН3
СН3 О СН2 СН3
СН3 СНОН СН2 СН2 СН3
С
СН3
СН3 СН СН2 СН2 ОН
Н3 СНОН СН3
а
ОН СН3 СН3
СН2 СН СН СН3
аа
а
СН3
СН3 СН СН2 СН2 ОН
аа
Гомологи: ___________________________________________________________________
Ізомери _____________________________________________________________________
Скласти формули спиртів:
2-метилгексан-2-ол
2,2-диметилбутан-1-ол
3,4-диметилпентан-2-ол
2-метилпентан-1-ол
Порівняти кислотні властивості спиртів:
2-бромопропан-1-ол і 2-фторопропан-1-ол
метанол і етанол
2,2,2-трифтороетан-1-ол і 2,2-дифтороетан-1-ол
Написати рівняння реакцій:
етанол + натрій
етанол + магній
етанол + натрій гідроксид
натрій етилат + н2о
1-пропанол + HBr
етанол + NaBr + H2SO4
пропен + Н2О
етаналь + Н2
р. Лєбєдєва
пропанон + Н2
2-пропанол + CuO (t0)
етанол + CuO (t0)
натрій етилат + хлорометан
пропан-1-ол + HNO3 (t0 ,H2SO4)
2-метилпропан-2-ол (t0 > 1700C, H2SO4 надл)
пропан-1-ол (t0 < 1700C, H2SO4 нестача)
3-метилбутан-2-ол (t0 > 1700C, H2SO4)
3-метилбутан-2-ол (t0 < 1700C, H2SO4)
2-метил-бут-2-ен + вода (t0, H2SO4)
2-хлоропропан + КОН (водний розчин)
етанол + пропан-2-ол (t0 < 1700C, H2SO4)
бутан-1-ол + купрум (ІІ) оксид
пропан-1-ол + сульфатна кислота
Написати рівняння реакції, в якій за допомогою синтезу Вільямсона отримати 2-метоксипропан
Написати рівняння реакцій, скласти електронний баланс, визначити окисник та відновник. Обчислити суму коефіцієнтів в кожному з рівнянь реакціії.
пропан-1-ол + CrO3 + H2SO4
пропан-2-ол + CrO3 + H2SO4
2-метилпропан-2-ол + CrO3 + H2SO4
Написати рівняння реакцій за допомогою яких можна отримати етанол з вапняку.
Написати формули спиртів, які отримали гідратацією:
бут-1-ену
пент-2-ену
2-метилпропену
Визначити, які дві речовини вступили в реакцію та за яких умов, якщо в результаті реакції утворились такі речовини:
2-бромопропан + Н2О
1-метоксипропан + NaCl
2-бутанон + Н2О
пропаналь + Cu + H2O
пропан-1-ол + HCl
пропіл нітрат + Н2О
Написати рівняння реакцій за допомогою яких можна здійснити ланцюжок перетворень:
етен хлороетан етанол етен вуглекислий газ синтез газ
етен етанол бута-1,3-дієн дивініловий каучук
1-хлоропропан 1-пропанол пропен ? 1,3,5-триметилбензен
пропан-1-ол ? пропан-2-ол (t0 < 1700C)
пропан-1-ол А В 2,3-диметилбутан
+H2O
+H2O
+H2
+ CH3COOH Кальцій
карбід
А
М
Q
D
fff
f
+КОН (в. р-н) kat - H2SO4, t0 +HCl +КОН (в. р-н)
1-хлоропропан А М Q D
ffff
Тренувальні задачі
Масова частка Карбону, Гідрогену, Оксигену в органічній речовині відповідно дорівнює 60%, 13,3%, 26,7%. Відносна густина парів речовини за повітрям – 2,069. Вивести формулу речовини. [C3H8O]
При спалюванні 18,4 г органічної речовини отримали 35,2 г вуглекислого газу та 21,6 г води. Відносна густина парів речовини за воднем – 23. Вивести формулу речовини. [C2H5OH]
Виведіть формулу одноатомного насиченого спирту, масова частка Оксисену в якому становить 15,7%
При спалюванні 2,3 г органічної речовини утворилось 2,24 л (н.у.) вуглекислого газу та 2,7 г води. Відносна густина пари речовини за повітрям – 1,59. Визначити молекулярну формулу сполуки. [C2H6O]
Визначити формулу алканолу, при взаємодії 14,8 г якого з металічним натрієм виділяється 2,24 л (н.у.) газу. [C4H9OH]
При дегідратації насиченого третинного спирту масою 18,5 г виділилось 4,5 г води. Назвіть спирт, складіть структурну формулу.
При міжмолекулярній дегідратації насиченого одноатомного спирту масою 100 г виділилось 21,09 г води, її вихід від теоретично можливого становив 75%. Визначити формулу спирту. [CH3OH]
При взаємодії 16 мл невідомого насиченого одноатомного спирту (густина = 0,8 г/см3) з натрієм виділився водень, достатній для повного гідрування 1,56 л (н.у.) ацетилену. Визначити формулу спирту. [C2H5OH]
При міжмолекулярній дегідратації насиченого одноатомного спирту утворився етер масою 24,05 г, а при внутрішньо молекулярній дегідратації такої самої кількості спирту одержали вуглеводень, який може приєднати 14,56 л водню (н.у.). Визначити формулу спирту. [C2H5OH]
Еквімолярна суміш метанолу та етанолу повністю реагує з хлороводнем, добутим при дії надлишку концентрованої сульфатної кислоти на 11,7 г натрій хлориду. Визначити масову частку метанолу у вихідній суміші. [41%]
Визначити масу етеру, яку можна одержати з 0.2 моль 1-пропанолу, якщо процес дегідратації відбувається з виходом 75%. [7,65 г]
Визначити, яку масу бутадієну можна одержати з 500 л етанолу (густина = 0,8 г/см3), масова частка води в якому 2%, якщо реакція відбувається з виходом 80%. [184,1 кг]
Визначити об’єм водню (н.у.), який виділиться при взаємодії 11,5 г натрію та 47,92 мл (густина = 0,8 г/см3) 96% етилового спирту. [5,6 л]
При взаємодії чадного газу об’ємом 19,25 л (н.у.) і водню об’ємом 57,75 л (н.у.) одержали метанол масою 20.5 г. Визначити масову частку виходу спирту від теоретично можливого. [74,5%]
Визначити об’єм етилену (н.у.) необхідного для добування 54 г етилового спирту, якщо вихід продукту від теоретично можливого становить 80%. [32,9 л]
У лабораторії із 129 г бромоетану отримали 45 г етанолу. Визначити вихід продукту від теоретично можливого. [82,3 %]
Змішали 200 г 5% водного розчину етанолу та 50 г 10% розчину етанолу. Обчислити масову частку етанолу у розчині, що утворився.
Який об’єм етену(н.у. потрібний для добування 2 т етанолу, якщо вихід спирту становить 833%
Після перетворення метанолу на хлорометан маса продукту реакції виявилась такою самою, як маса взятого спирту. Обчисліть відносний вихід хлором етану.
Під час спалювання 0,5 л етанолу (густина 0,79 г/мл) виділилось 11300 кДж теплоти. Напишіть відповідне термохімічне рівняння реакції.
