
- •Раздел 4. Свойства растворов
- •4.1 Общие свойства растворов
- •Замерзание и кипение растворов
- •Осмотическое давление
- •4.2 Равновесия в растворах электролитов
- •Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •Кислотно-основные равновесия. Водородный показатель рН
- •Реакция среды характеризуется через водородный показатель
- •Равновесия в растворах солей. Гидролиз
- •Влияние различных факторов на полноту течения гидролиза
- •4.5 Заключение
Кислотно-основные равновесия. Водородный показатель рН
Вода является очень слабым электролитом и диссоциирует по уравнению
Н2О ↔ Н+ + ОН‾.
В любом водном растворе при 22 0С произведение концентраций ионов воды (ионное произведение воды – КW) является величиной постоянной:
КW = [Н+] ∙ [OH─] = 10–14,
где [Н+] ─ равновесная концентрация ионов Н+;
[OH─] ─ равновесная концентрация ионов ОН─.
В нейтральной среде [Н+] = [OH─] = 10–7 моль/л;
в кислой среде [Н+] > [OH─] , т.е. [Н+] >10–7 моль/л ,
например [Н+] = 10–6 моль/л;
в щелочной среде [Н+] < [OH─] , т.е. [Н+] < 10–7 моль/л,
например [Н+] = 10–8 моль/л.
Реакция среды характеризуется через водородный показатель
pH = ─ lg [Н+].
При решении задач будем пользоваться формулой pН = – lg сH+ . В более точных расчётах следует пользоваться активностью ─ pН = – lg аH+ .
Если подставить значения концентраций ионов водорода сH+, полученные в вышеприведённом примере, в формулу для вычисления рН, то получим:
в нейтральной среде: рН = ─ lg 10–7 = 7;
в кислой среде: рН = ─ lg 10–6 = 6;
в щелочной среде: рН = ─ lg 10–8 = 8.
Следовательно:
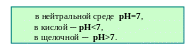
Данные сведения находят отражение в шкале рН (рис. 4.8).

Рис. 4.8 – Шкала рН
Наиболее простым способом оценки рН среды является использование кислотно-основных индикаторов, которые по своему составу относятся к слабым органическим кислотам или основаниям. Например, индикатор метиловый оранжевый представляет слабую органическую кислоту, электролитическую диссоциацию которой условно можно представить следующим образом:
HJnd ↔ H+ + Jnd– .
кислотная форма основная форма
(красная) (жёлтая)
Окраска индикаторов зависит от строения молекул и определяется наличием особых групп – хромофоров. Изменение окраски индикатора происходит в определённом интервале рН:

Метиловый оранжевый меняет свою окраску в интервале : рН = (3,1 – 4,4 ).
Окраска некоторых индикаторов в различных средах приводится на рис. 4.9.
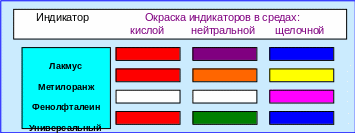
Рис. 4.9 – Окраска некоторых индикаторов в различных средах
Равновесия в растворах солей. Гидролиз
При растворении соли в воде происходит её электролитическая диссоциация на анионы и катионы, которые могут взаимодействовать с водой. Гидролизу подвергаются ионы слабых электролитов. Если катион соли является остатком слабого основания, то в результате взаимодействия с водой образуется слабое основание (соль гидролизуется по катиону). Если анион соли – остаток слабой кислоты, то в результате гидролиза образуется слабая кислота (соль гидролизуется по аниону).
Хлорид аммония NH4Cl образован слабым основанием NH4OH и сильной кислотой HCl. При растворении соль вступает в обменное взаимодействие с водой. Напишем молекулярное и ионно-молекулярные уравнения гидролиза данной соли
NH4Cl + HOH ↔ NH4OH + HCl;
слабый электролит слабый электролит
NH4+ + Cl‾+ HOH ↔ NH4OH + H+ + Cl‾;
NH4+ + HOH ↔ NH4OH + H+.
В данном случае устанавливается ионно-молекулярное равновесие, так как слабый электролит (Н2О) является одним из исходных веществ и слабое основание NH4OH – один из продуктов реакции.

В результате взаимодействия с водой хлорида аммония в растворе накапливаются свободные ионы Н+ и реакция среды становится кислой, т.к. СН+ > СОН ˉ . Раствор данной соли окрасит лакмус и универсальный индикатор в красный цвет. NH4Cl гидролизуется по катиону, который является остатком слабого основания.
Нитрит натрия NaNO2 образован слабой кислотой HNO2 и сильным основанием NaOH. Уравнения гидролиза нитрита натрия выглядят так:
NaNO2 + HOH ↔ NaOH + HNO2;
слабый электролит слабый электролит
Na+ + NO2‾ + HOH ↔ Na+ + OH‾ + HNO2;
NO2‾ + HOH ↔ OH‾ + HNO2.
Реакция среды в растворе нитрита натрия щелочная вследствие накопления свободных ионов ОН ˉ, так как СН+ < СОНˉ. Причиной гидролиза является образование слабой кислоты – HNO2 , т.о. NaNO2 гидролизуется по аниону, раствор нитрита натрия фенолфталеин окрасит в малиновый цвет, лакмус, метилоранж и универсальный индикатор − в красный цвет.
Нитрит аммония образован слабым основанием NH4OH и слабой кислотой HNO2. При взаимодействии с водой образуются данные слабые электролиты:
NH4 NO2 + НОН ↔ NH4OH + HNO2;
слабый электролит слабый электролит
NH4+ + NO2‾ + НОН ↔ NH4OH + HNO2.
В данном случае рН среды меняется незначительно, т.к. СН+ ≈ СОН–.
NH4NO2 гидролизуется как по катиону, так и по аниону.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, и pH среды не меняется, например:
NaCl + HOH ↔ NaOH + HCl;
слабый электролит
Na+ + Cl‾ + HOH ↔ Na+ + OH– + H+ + Cl‾;
HOH ↔ H+ + OH‾ .

Формально реакция гидролиза соли обратна реакции нейтрализации, в результате которой соль образуется.

