
- •Раздел 4. Свойства растворов
- •4.1 Общие свойства растворов
- •Замерзание и кипение растворов
- •Осмотическое давление
- •4.2 Равновесия в растворах электролитов
- •Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •Кислотно-основные равновесия. Водородный показатель рН
- •Реакция среды характеризуется через водородный показатель
- •Равновесия в растворах солей. Гидролиз
- •Влияние различных факторов на полноту течения гидролиза
- •4.5 Заключение
Ионно-молекулярные равновесия
Реакции в растворах электролитов протекают между ионами растворённых веществ. Рассмотрим реакции двойного обмена. Любой электролит в результате электролитической диссоциации образует анионы и катионы, поэтому вне зависимости от того, имеются или не имеются ионы в веществе, условно электролиты можно представить состоящими из анионов и катионов. В реакциях двойного обмена происходит обмен ионами между взаимодействующими веществами (рис. 4.5).

Рис. 4.5 – Реакции двойного обмена
Решить вопрос о возможности протекания практически необратимых реакций двойного обмена и понять их сущность позволяют ионно-молекулярные реакции.
Правила составления уравнений ионно-молекулярных реакций
1. Составляется молекулярное уравнение реакции. Формулы веществ записываются в соответствии с правилом валентности. Рассчитываются (если необходимо) коэффициенты в соответствии с законом сохранения массы веществ.
2. Составляется полное ионно-молекулярное уравнение. В молекулярной форме следует записывать малорастворимые и газообразные вещества, а также слабые электролиты (табл. 4.4, 4.5). Все эти вещества или не образуют в растворах ионов, или образуют их очень мало. В виде ионов записывают сильные кислоты и основания, а также растворимые соли. Эти электролиты существуют в растворе в виде ионов, но не молекул.
3. Составляется сокращённое ионно-молекулярное уравнение. Ионы, которые в ходе реакции не изменяются, сокращаются. Полученное уравнение показывает суть реакции.

Таблица 4.5
Растворимость солей кислот и оснований в воде
Катион |
H+ |
K+, Na+ |
NH4+ |
Mg2+ |
Ca2+ |
Cu2+ |
Zn2+ |
Mn2+ |
Fe2+ |
Fe3+ |
AI3+ |
Ва2+ |
Анион |
||||||||||||
OH- |
|
Р |
Р |
Н |
М |
Н |
Н |
Н |
Н |
Н |
Н |
Р |
CI- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
NO3- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
S2- |
Р |
Р |
Р |
─ |
─ |
Н |
Н |
Н |
Н |
Н |
─ |
─ |
SO32- |
Р |
Р |
Р |
М |
М |
─ |
М |
Н |
М |
─ |
─ |
Н |
SO42- |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
CO32- |
Р |
Р |
Р |
М |
Н |
Н |
Н |
─ |
Н |
─ |
─ |
Н |
HCO3– |
Р |
Р |
Р |
Р |
Р |
─ |
─ |
─ |
Р |
Р |
Р |
Р |
SiO32- |
Н |
Р |
Р |
Н |
Н |
Н |
Н |
─ |
Н |
Н |
Н |
Н |
РО43─ |
Р |
Р |
─ |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Примечание. Р ─ растворимое вещество, М ─ малорастворимое,
Н ─ нерастворимое, «─» ─ разлагается водой
В качестве примера решим вопрос о том, в каком случае произойдет химическое взаимодействие: если к раствору хлорида кальция добавить раствор нитрата натрия или сульфата натрия? Ответ подтвердите, написав ионно-молекулярные реакции.
Запишем молекулярные уравнения предполагаемых реакций, указав растворимость всех участников реакции ( Р – растворимое, Н – нерастворимое ). Все растворимые соли являются сильными электролитами.
CaCl2 + 2NaNO3 → Ca(NO3)2 + 2NaCl; CaCl2 + Na2SO4 → CaSO4↓ + 2NaCl.
Р Р Р Р Р Р Н Р
В соответствии с правилами написания ионно-молекулярных уравнений сильные, растворимые электролиты запишем в виде ионов, а слабые или нерастворимые – в виде молекул.
Ca2+ + 2Cl‾ + 2Na+ + 2NO3‾ → Ca2+ + 2NO3‾ + 2Na+ + 2Cl‾;
Ca2+ + 2Cl‾ + 2Na+ + SO4 2‾ → CaSO4 ↓ + 2Na+ + 2Cl‾.
В первом случае все ионы сокращаются, а во втором – сокращенное ионно-молекулярное уравнение имеет вид: Ca2+ + SO42‾ → CaSO4 ↓, т.е. в данном случае имеет место химическое взаимодействие с образованием малорастворимого вещества. Данная реакция является практически необратимой, т.к. в обратном направлении, т.е. в сторону растворения осадка, она протекает в очень незначительной степени (рис. 4.6).
Рассмотрим реакции, приводящие к образованию слабого электролита и газа (рис. 4.7).
NH4Cl + KOH → NH4OH + KCl,
NH4+ + Cl¯ + K+ + OH¯ → NH4OH + K+ + Cl¯,
NH4+ + OH¯ → NH4OH.
Na2CO3 + 2 HCl → 2 NaCl + H2CO3 (H2O + CO2↑),
2 Na+ + CO32¯ + 2 H+ + 2 Cl → 2 Na+ + 2 Cl¯ + H2O + CO2↑,
2 H+ + CO32¯ → H2O + CO2↑.
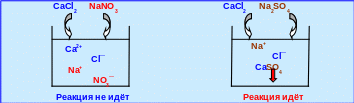
Рис. 4.6 – Практически необратимая реакция двойного обмена с образованием осадка
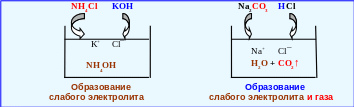
Рис. 4.7 – Практически необратимые реакции двойного обмена
с образованием слабого электролита и газа

Если малорастворимые или малодиссоциирующие вещества есть и среди исходных веществ и среди продуктов реакции, то ионно-молекулярное равновесие смещается в сторону менее диссоциирующего или менее растворимого электролита.
СН3СООН + NaOH ↔ CH3COONa + H2O,
СН3СООН + Na + + OH¯ ↔ СН3СОО¯ +Na+ + H2O,
СН3СООН + OH¯ ↔ СН3СОО¯ + H2O.
слабая кислота слабый электролит
Константа диссоциации уксусной кислоты равна около 10–5 , а воды около 10–16 , т.е. вода является более слабым электролитом и равновесие смещено в сторону образования продуктов реакции.
На смещении ионно-молекулярного равновесия основано растворение малорастворимого гидроксида магния при добавлении порциями раствора хлорида аммония:
Mg(OH)2 + 2 NH4Cl ↔ MgCl2 + 2 NH4OH,
Mg(OH)2 + 2 NH4+ + 2 Cl¯ ↔ Mg2+ + 2 Cl¯ + 2 NH4OH,
Mg(OH)2 + 2 NH4+ ↔ Mg2+ + 2 NH4OH.
Введение дополнительных порций иона NH4+ смещает равновесие в сторону продуктов реакции.
