
- •Раздел 1. Строение вещества
- •1.1. Строение атома и периодическая система д.И. Менделеева
- •Квантовая механика
- •Квантовые числа
- •Распределение электронов в атоме
- •Электронные формулы
- •Периодическая система д.И. Менделеева и свойства элементов
- •Атомные радиусы
- •Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •Металличность и неметалличность
- •1.2. Химическая связь
- •Энергия химической связи
- •Длина химической связи
- •Электрический момент диполя и направленность связи
- •Ионная химическая связь
- •Ковалентная химическая связь
- •Метод валентных связей
- •Свойства ковалентной связи
- •Направленность ковалентной связи
- •Кратность химической связи
- •Металлическая связь
Энергия химической связи
Мерой прочности химической связи служит энергия связи. Её величина определяется работой, необходимой для разрушения связи, или выигрышем в энергии при образовании вещества из отдельных атомов. Например, энергия связи Н – Н в молекуле водорода равно 435 кДж/моль. Это значит, что при образовании 1 моль газообразного водорода из изолированных атомов по уравнению:
Н + Н = Н2 ∆rН = − 435 кДж/моль,
выделяется 435 кДж. Такое же количество энергии должно быть затрачено на распад 1 моль Н2 до атомарного состояния (энергия атомизации молекулы).
Представления об энергии связи является универсальным и в равной мере приложимы как к молекулам, так и к кристаллическому состоянию. Однако величина энергии связи при переходе от молекул к кристаллу изменяется, поскольку при этом изменяются координационное число (количество связей в расчете на один атом) и энергетическое состояние атомов. Энергия связи в рядах однотипных соединений, как для газообразных молекул, так и для кристаллов изменяются закономерно.
Длина химической связи
Длина химической связи l связи равна расстоянию между центрами ядер атомов в молекуле (или кристалле). Длину связи определяют экспериментально по рентгеноструктурным и спектральным данным. Она зависит от размеров электронных оболочек и степени их перекрывания. Длина связи увеличивается с возрастанием атомного номера элемента. Также имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и соответственно устойчивость молекул.
Электрический момент диполя и направленность связи
Химическая связь характеризуется определенной пространственной направленностью.
Если двухатомные молекулы всегда линейны, то формы многоатомных молекул могут быть различными. Так, трехатомные молекулы типа АВ2 бывают как линейными (СО2, HgCl2), так и угловыми (Н2О, SO2, H2S). Пространственное строение может быть выявлено различными методами, например, исследование вращательных спектров молекул в дальней ИК- области, определение электрических моментов диполей и др.
Электрический момент диполя является мерой полярности молекулы. Между взаимодействующими атомами, которые различаются по электроотрицательности, возникают полярные связи. В результате смещения электронной плотности в сторону более электроотрицательного партнера происходит разделение «центров тяжести» положительного и отрицательного зарядов и возникает диполь, представляющий собой систему из двух равных и противоположных по знаку зарядов + и ‾, находящихся на определенном расстоянии l (длина диполя) друг от друга. Диполь выражают через электрический момент диполя , который представляет собой произведение заряда на длину диполя l: = l.
Например, строение линейной молекулы СО2, можно представить следующим образом:
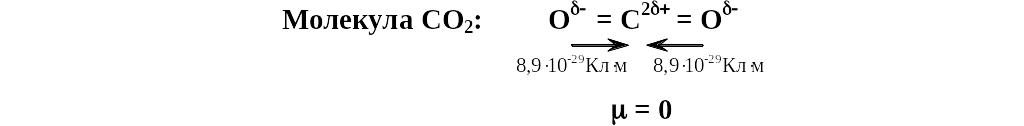
Направление электрического момента диполя условно принимают от отрицательного к положительному полюсу диполя. Классическим примером диполя могут служить угловая молекула воды, в которой электрические моменты диполя каждой связи О – Н равны 5,2 10-29 Кл м, а электрический момент диполя молекулы воды в целом составляет 6,07 10-29 Кл м. Следовательно, электрические моменты диполя связей складываются геометрически и связи О – Н должны быть направлены под углом 105 ° друг к другу (рис. 1.3.). Таким образом, существование электрических моментов диполей в молекулах и их величина определяются пространственной направленностью химической связи.
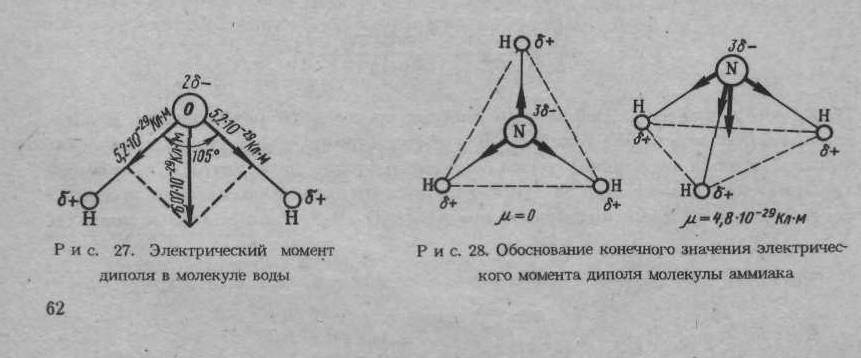
Рис. 1.3. Электрический момент диполя в молекуле воды
Таким образом, к основным чертам химической связи можно отнести.
∙ Снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована;
∙ Перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
К основным видам химической связи относятся ионная, ковалентная и металлическая связи. Кроме того, между молекулами возникает водородная химическая связь и происходит Ван-дер-Вальсовы взаимодействия (рис. 1.4.).
