
- •Бийский технологический институт (филиал)
- •Степанова н. В. Бийск 2006 г
- •1 Классификация и характеристики физико-химических методов анализа
- •2.Оптические методы анализа
- •2.1 Классификация оптических методов анализа
- •2.1.1 Молекулярно-абсорбционные методы
- •2.1.2 Колориметрия
- •2.1.3 Фотоколориметрия
- •2.1.4 Фотометрические определения
- •2.2 Атомный спектральный анализ
- •2.3 Другие оптические методы анализа
- •2.3.1 Рефрактометрия
- •2.3.2 Поляриметрия
- •2.3.3 Нефелометрический и турбидиметрический анализ
- •2.3.4 Флюориметрия
- •2.3.5 Масс-спектрометрия
- •3. Электрохимические методы анализа
- •3.1 Классификация электрохимических методов анализа
- •3.2 Потенциометрия
- •3.3 Кондуктометрия. Кондуктометрическое титрование
- •3.4 Кулонометрия. Кулонометрическое титрование
- •3.5 Вольтампермические методы. Полярография.
- •4. Хроматографические методы анализа
- •4.1 Классификация методов хроматографии
- •4.2 Основные узлы приборов для хроматографического анализа
- •4.3 Газовая хроматография
- •5. Термические методы анализа
- •5.1 Термометрия
2.3.5 Масс-спектрометрия
Macc-спектрометрия основана на разделении ионов по массе и заряду при их прохождении через магнитное или электрическое поле. Macc-спектрометрия использует основное физическое свойство вещества – величину молекулярной или атомной массы, поэтому позволяет определить состав вещества или частей (фрагментов) его молекулы.
Процесс
масс-спектрометрического разделения
проводится в вакуумной камере (![]() Па),
куда впрыскивается пучок частиц 2
(рисунок 11) ионизированного вещества.
Ионизация молекул и атомов, фрагментация
молекул на ионы производится
воздействием на вещество потока
электронов 3 высокой энергии или
другими способами. При этом получаются
положительно заряженные ионы, пучок
которых 1 подвергается разделению
в камере масс-спектрометра с помощью
магнитного поля, по времени пролета
или в электрическом поле. В
спектрометрах, работающих на принципе
магнитного поля, пучок ионов проходит
через перпендикулярно направленное
магнитное поле (рисунок 11), образуемое
магнитом 8, под воздействием поля ионы
разной массы и заряда отклоняются
по-разному и на выходе распределяются
на несколько пучков 7 (одинаковой массы
и заряда). Полученный масс-спектр
фиксируют специальными детекторами 4,
сигнал которых усиливается в усилителе
5 и регистрируется самописцем 6 или
осциллографом. В масс-спектрометрах,
работающих на принципе разделения
ионов по времени пролета, используется
способность ионов, обладающих меньшей
массой (меньшая инерция), получать
большую скорость в электрическом
ускоряющем поле. Ионы разной массы
достигают приемника ионов (детектора)
за различное время.
Па),
куда впрыскивается пучок частиц 2
(рисунок 11) ионизированного вещества.
Ионизация молекул и атомов, фрагментация
молекул на ионы производится
воздействием на вещество потока
электронов 3 высокой энергии или
другими способами. При этом получаются
положительно заряженные ионы, пучок
которых 1 подвергается разделению
в камере масс-спектрометра с помощью
магнитного поля, по времени пролета
или в электрическом поле. В
спектрометрах, работающих на принципе
магнитного поля, пучок ионов проходит
через перпендикулярно направленное
магнитное поле (рисунок 11), образуемое
магнитом 8, под воздействием поля ионы
разной массы и заряда отклоняются
по-разному и на выходе распределяются
на несколько пучков 7 (одинаковой массы
и заряда). Полученный масс-спектр
фиксируют специальными детекторами 4,
сигнал которых усиливается в усилителе
5 и регистрируется самописцем 6 или
осциллографом. В масс-спектрометрах,
работающих на принципе разделения
ионов по времени пролета, используется
способность ионов, обладающих меньшей
массой (меньшая инерция), получать
большую скорость в электрическом
ускоряющем поле. Ионы разной массы
достигают приемника ионов (детектора)
за различное время.
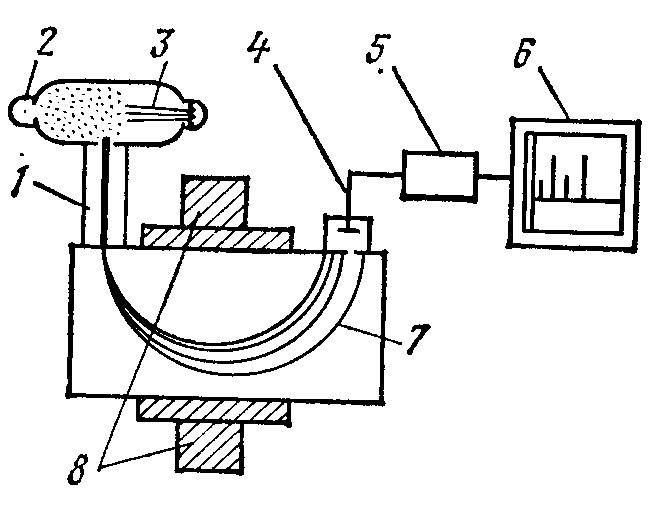
Рисунок 11 – Схема масс-спектрометра, работающего на принципе разделения ионов в магнитном поле
 Macс-спектрометрический
метод применяется для анализа смесей
газов и летучих веществ, так как позволяет
быстро и с высокой надежностью установить
состав смеси. Развивается
масс-спектрометрический анализ
органических соединений, основанный
на фрагментации (распаде на части)
молекул под воздействием электронного
излучения. Например, н-бутиловый
спирт преобразуется в ряд ионов,
регистрируемых в масс-спектре
(рисунок 12).
Macс-спектрометрический
метод применяется для анализа смесей
газов и летучих веществ, так как позволяет
быстро и с высокой надежностью установить
состав смеси. Развивается
масс-спектрометрический анализ
органических соединений, основанный
на фрагментации (распаде на части)
молекул под воздействием электронного
излучения. Например, н-бутиловый
спирт преобразуется в ряд ионов,
регистрируемых в масс-спектре
(рисунок 12).
Рисунок 12 – Масс-спектр н-бутилового спирта
По массовым числам (мас. ч) получаемых фрагментов молекулы вещества можно сделать заключение о его строении и провести в случае необходимости количественное определение.
В последнее время получили развитие комбинированные методы, в которых масс-спектрометр выполняет функцию анализатора состава вещества. Особенно широкое развитие получила комбинация – газо-жидкостный хроматограф – масс-спектрометр. Фракции веществ на выходе газо-жидкостного хроматографа подаются в масс-спектрометр, который производит анализ каждой фракции и автоматически выдает результат анализа смеси.
3. Электрохимические методы анализа
3.1 Классификация электрохимических методов анализа
Электрохимические методы основаны на измерении электрических параметров электрохимических явлений, возникающих в исследуемом растворе. Такое измерение осуществляют с помощью электрохимической ячейки, представляющей собой сосуд с исследуемым раствором, в который помещены электроды. Электрохимические процессы в растворе сопровождаются появлением или изменением разности потенциалов между электродами или изменением величины тока, проходящего через раствор.
Электрохимические методы классифицируют в зависимости от типа явлений, замеряемых в процессе анализа. В общем случае различают две группы электрохимических методов:
1. Методы без наложения постороннего потенциала, основанные на измерении разности потенциалов, который возникает в электрохимической ячейке, состоящей из электродов и сосуда с исследуемым раствором. Эту группу методов называют потенциометрическими. В потенциометрических методах используют зависимость равновесного потенциала электродов от концентрации ионов, участвующих в электрохимической реакции на электродах.
2. Методы с наложением постороннего потенциала, основанные на измерении: а) электрической проводимости растворов – кондуктометрия; б) количества электричества, прошедшего через раствор, – кулонометрия; в) зависимости величины тока от приложенного потенциала – вольт-амперометрия; г) времени, необходимого для прохождения электрохимической реакции, – хроноэлектрохимические методы (хроновольтамперометрия, хронокондуктометрия). В методах этой группы на электроды электрохимической ячейки налагают посторонний потенциал.
Основным элементом приборов для электрохимического анализа является электрохимическая ячейка. В методах без наложения постороннего потенциала она представляет собой гальванический элемент, в котором вследствие протекания химических окислительно-восстановительных реакций возникает электрический ток. В ячейке типа гальванического элемента в контакте с анализируемым раствором находятся два электрода – индикаторный электрод, потенциал которого зависит от концентрации вещества, и электрод с постоянным потенциалом – электрод сравнения, относительно которого измеряют потенциал индикаторного электрода. Измерение разности потенциалов производят специальными приборами потенциометрами.
В методах с наложением постороннего потенциала применяют электролитическую ячейку, названную так потому, что на электродах ячейки под действием наложенного потенциала происходит электролиз – окисление или восстановление веществ. В кондуктометрическом анализе используют кондуктометрическую ячейку, в которой замеряют электрическую проводимость раствора. По способу применения электрохимические методы можно классифицировать на прямые, в которых концентрацию веществ измеряют по показанию прибора, и электрохимическое титрование, где индикацию точки эквивалентности фиксируют с помощью электрохимических измерений. В соответствии с этой классификацией различают потенциометрию и потенциометрическое титрование, кондуктометрию и кондуктометрическое титрование и т. д.
Приборы для электрохимических определений кроме электрохимической ячейки, мешалки, нагрузочного сопротивления включают устройства для измерения разности потенциалов, тока, сопротивления раствора, количества электричества. Эти измерения могут осуществляться стрелочными приборами (вольтметр или микроамперметр), осциллографами, автоматическими самопишущими потенциометрами. Если электрический сигнал от ячейки очень слабый, его усиливают с помощью радиотехнических усилителей. В приборах методов с наложением постороннего потенциала важной частью являются устройства для подачи на ячейку соответствующего потенциала стабилизированного постоянного или переменного тока (зависит от типа метода). Блок электропитания приборов электрохимического анализа включает обычно выпрямитель и стабилизатор напряжения, который обеспечивает постоянство работы прибора.
