
- •Глава 14. Железо и сплавы на его основе
- •14.1. Диаграмма состояния железоуглеродистых сплавов
- •Характерные точки и линии на диаграмме Fe – Fe3c
- •14.2. Классификация и маркировка углеродистых сплавов
- •14. 3.Структурные классы и маркировка легированных сталей
- •Классификация по назначению
- •Маркировка легированных сталей
Глава 14. Железо и сплавы на его основе
Железо по распространенности в земной коре занимает четвертое место после кислорода, кремния и алюминия. Ценные свойства железа и возможность получения на его основе разнообразных сплавов сделали его основным материалом, используемым в современной технике. Применимость сплавов на его основе в настоящее время составляет около 90% от общего количества применяемых металлов.
Химически чистое железо – серого цвета с удельным весом 7,89 т/м3. Обладает высокой тепло-, электропроводностью и магнитной проницаемостью, имеет высокую пластичность, хорошо деформируется при обработке металлов давлением (ОМД) и сваривается (рис. 14.1).
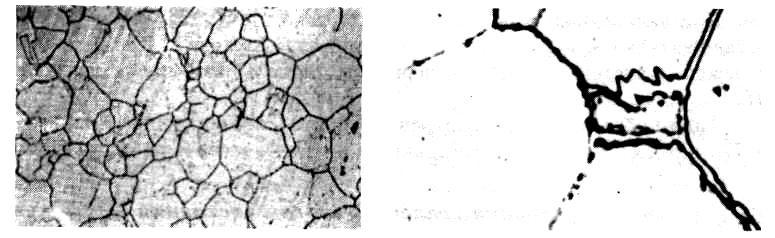
а б Рис. 14.1. Микроструктура технически чистого железа:
а – меньше 0,006% С 300; б – 0,01%С 600
Сплавы на основе железа (стали и чугуны) находят широкое применение во всех областях машиностроения, техники и при изготовлении медицинских инструментов. Температура плавления Tпл = 1536 ÷ 1539 ºC (зависит от чистоты железа). Обладает полиморфизмом. Твердость железа составляет 80 HB; пластичность δ = 50%; ψ = 65%. Основным легирующим элементом в сплавах на основе железа является углерод, который эффективно повышает его прочностные свойства (σт, σ0,2). Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы Fe – C, которая находит практическое применение для изучения фазовых и структурных превращений в процессе медленного нагрева и охлаждения. По диаграмме определяют оптимальные температуры при термической, химико-термической, термомеханической обработке, при выборе температуры заливки форм и параметров сварки. Имеются две диаграммы состояния Fe – C: метастабильная, характеризующая превращение в системе Fe – Fe3C (железо – цементит), и стабильная, характеризующая превращение в системе Fe – C (железо – графит).
14.1. Диаграмма состояния железоуглеродистых сплавов
Диаграмма состояния Fe – Fe3C характеризует фазовый состав и превращения в сплавах с концентрацией от чистого железа до цементита (рис. 14.2).
Фазы в сплавах железа с углеродом представляют собой жидкий раствор, феррит, аустенит, цементит, ледебурит и свободный углерод в виде графита.
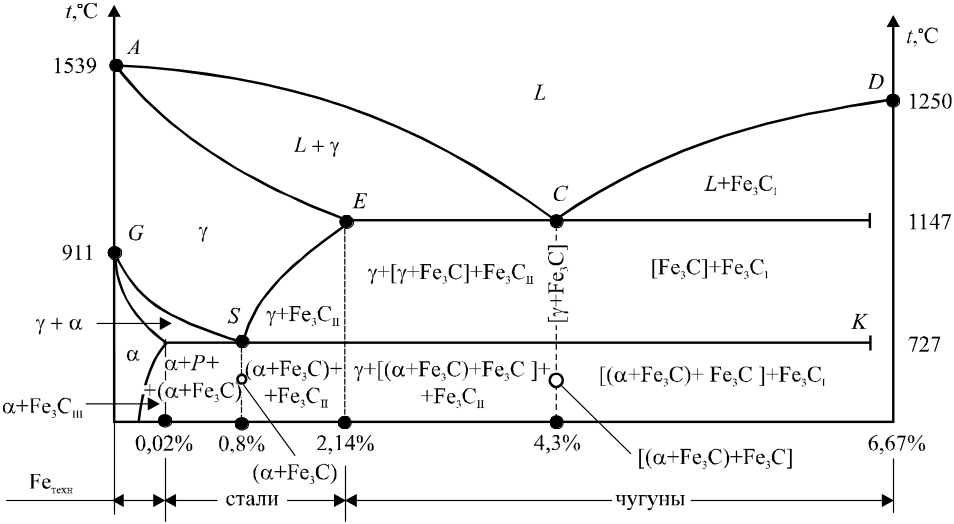
Рис. 14.2. Диаграмма состояния сплавов Fe – Fe3C
Феррит (α) – твердый раствор внедрения углерода в Feα. Он имеет решетку ОЦК, растворимость углерода в Feα обусловлена малыми размерами межатомных пар в ОЦК решетке. Значительная доля атомов углерода вынуждена размещаться на дефектах (вакансиях, дислокациях).
Феррит, кроме углерода, растворяет и другие элементы. С азотом он образует твердый раствор внедрения, а с легирующими металлами – твердые растворы замещения. Феррит – мягкая, пластичная фаза, с твердостью НВ 80 –100.
Аустенит (γ) – твердый раствор внедрения углерода в Feγ. Имеет ГЦК решетку, межатомные размеры которой почти в два раза больше, чем в ОЦК, поэтому растворимость углерода в Feγ достаточно велика и составляет 2,14%. Аустенит, как и феррит, может растворять и другие элементы, при этом металлы образуют твердые растворы замещения. Аустенит пластичен, но более прочен, чем феррит (НВ 160 – 200).
Цементит – химическое соединение железа с углеродом (Fe3C). Он содержит 6,67%С и имеет сложную ромбическую решетку. Цементит тверд и хрупок (НВ800). При высоких температурах цементит неустойчив и разлагается на графит и аустенит, поэтому температура плавления цементита точно не определена и принимается равной 1600 °C.
Ледебурит – эвтектичная смесь аустенита и цементита при t = 1147–727C и смесь перлита и цементита при t < 727C.
Графит – углерод, выделяющийся в железоуглеродистых сплавах в свободном состоянии. Имеет гексагональную решетку. Графит электропроводен, химически стоек, мало прочен, мягок (НВ3).
