
- •Розділ і хімічна термодинаміка та кінетика. Основи електрохімії
- •Обробка результатів експерименту Розрахунок похибок вимірювань
- •Побудова графіків та графічні методи обробки експериментальних даних
- •2. Експериментальна частина
- •3. Обробка результатів
- •Контрольні запитання та завдання
- •Вплив концентрації на швидкість хімічної реакції
- •2. Експериментальна частина
- •3. Обробка результатів
- •1.2. Каталізуючий вплив іонів
- •Експериментальна частина
- •3. Обробка результатів
- •2. Експериментальна частина
- •3.Обробка результатів
- •4. Контрольні запитання та завдання
- •1.2. Вимірювання електропровідності розчину
- •1.3. Вимірювання опору розчинів компенсаційним методом
- •1.4. Метод кондуктометричного титрування
- •2. Визначення концентрації кислоти методом кондуктометричного титрування
- •2.1. Експериментальна частина
- •2.2. Обробка результатів
- •3. Визначення ступеня та константи дисоціації оцтової кислоти
- •3.1. Експериментальна частина
- •3.2. Обробка результатів
- •4. Контрольні запитання та завдання
- •1.2. Вимірювання електрорушійної сили гальванічного елемента компенсаційним методом
- •Вимірювання е.Р.С.
- •1.3. Методика вимірювань електрорушійної сили гальванічних елементів з використанням потенціометрів пптв
- •Вимірювання е.Р.С. Елемента Якобі-Даніеля і розрахунок електродних потенціалів цинкового та мідного електродів
- •2.1. Експериментальна частина
- •2.2. Обробка результатів
- •3. Електрометричне визначення рН розчину за допомогою хінгідронного електроду та рН-метру
- •3.1. Електрометричне визначення рН розчинів рН-метром
- •Панелі рН-метра
- •Електрода
- •3.2. Експериментальна частина
- •3.3. Обробка результатів
- •4. Контрольні запитання та завдання
- •Розділ іі Основи гальванотехніки
- •Лабораторна робота 7 Визначення розсіювальної здатності електролітів
- •1. Основні теоретичні положення
- •3. Обробка результатів
- •Контрольні запитання
- •Лабораторна робота 8 Електролітичне цинкування
- •1. Основні теоретичні положення
- •2. Вивчення впливу режиму електролізу та складу електроліту на якість цинкового покриття
- •2.1. Експериментальна частина
- •Уздовж поверхні катода:
- •3. Визначення виходу за струмом цинку
- •3.1. Експериментальна частина
- •2. Експериментальна частина
- •3. Контрольні запитання
- •Лабораторна робота 10 Електрохімічне полІрування металів
- •1. Основні теоретичні положення
- •2. Експериментальна частина
- •3. Контрольні запитання
- •Список рекомендованої літератури
2. Експериментальна частина
Зібрати гальваностатичну електричну схему та провести електроліз сірчанокислого електроліту міднення такого складу (г/л): СuSO4*5H2O - 220, H2SO4 - 50.
Матеріал катодів - сталь, латунь (або мідь), густина струму і = 2А/дм2, товщина покриття 5 - 8 мкм. Визначити вплив матеріалу катоду на міцність зчеплення покриття з основою та якість покриття.
Вивчити вплив катодної густини струму на якість покриття, осадженого з сульфатного електроліту (для цього використовують кілька послідовно сполучених електролізерів або кутову комірку Хулла). Визначити діапазон робочих густин струму (темні, порошкоподібні покриття вважаються неякісними). Катоди - латунні (мідні), товщина покриття 5 - 8 мкм.
3. Контрольні запитання
Назвати основні переваги та недоліки простих (кислих) та комплексних (лужних) електролітів.
Яка роль основних компонентів (сульфат міді, сірчана кислота, органічні добавки) сульфатних електролітів?
Назвати переваги ціанідних електролітів міднення. Чим вони обумовлені? Чому їх використання помітно зменшується?
Чи можна безпосередньо електролітично міднити стальні вироби? Дайте необхідні пояснення.
Перелічити основні галузі використання мідних покриттів.
Лабораторна робота 10 Електрохімічне полІрування металів
Мета роботи: ознайомитись з процесом електрохімічного полірування металів, визначити оптимальний режим полірування міді та її сплавів.
1. Основні теоретичні положення
Електрохімічне полірування - різновид електролітичної анодної обробки металів, у результаті якої відбувається електрохімічне розчинення поверхневого шару металу, усувається дефектний шар, що утворюється при проведенні попередніх механічних чи термічних операцій, та формується новий поверхневий шар с меншою висотою мікронерівностей і вирівненим рельєфом поверхні. Важливо, що поверхня виробів після полірування не лише стає блискучою, але й отримує кращі експлуатаційні характеристки та корозійну стійкість.
Закономірності процесу електрополірування розглянено на прикладі полірування міді у фосфорній кислоті.
В
Г
А
Рис. 19.
Поляризаційна крива при поліруванні





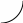
 і
Б Д
і
Б Д
На ділянці ВГ анодний струм перестає залежати від потенціалу. Розчинення металу в зоні плато відбувається в дифузійному режимі. Поверхня металу при цьому покривається оксидно-солевим шаром продуктів розчинення. Безпосередньо біля поверхні знаходиться в`язкий шар розчину з високою концентрацією продуктів анодної реакції. Розчинення металу в дифузійному режимі призводить до переважного розчинення мікровиступів та вирівнювання бугристої поверхні.
На ділянці ГД поляризаційної кривої відбувається виділення кисню, що визиває появу на поверхні зразка характерних дефектів. Отже, найякісніше полірування відбувається в діапазоні потенціалів, які відповідають плато (ділянка ВГ).
