
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
1.3.2. Комбинационное рассеивание
При комбинационном рассеивании для частоты рассеянного излучения выполняется условие:
![]() (1.7)
- частота
рассеянного комбинационного излучения
(1.7)
- частота
рассеянного комбинационного излучения
Где
![]() – частота падающего излучения,
– частота падающего излучения, ![]() – частота перехода для рассеивающих
атомных систем.
– частота перехода для рассеивающих
атомных систем.
Nβ:
Это условие соответствует тому, что
энергия падающего фотона ![]() уменьшается за счёт поглащения энергии
уменьшается за счёт поглащения энергии
![]() рассеивающей системой (переход системы
с более низкого уровня Ek
на более высокий Ei)
или увеличивается за счёт отдачи системой
такой же энергии (обратный переход с
более высокого Ei
на более низкий Ek).
В итоге получаются фотоны с энергией
рассеивающей системой (переход системы
с более низкого уровня Ek
на более высокий Ei)
или увеличивается за счёт отдачи системой
такой же энергии (обратный переход с
более высокого Ei
на более низкий Ek).
В итоге получаются фотоны с энергией
![]() (1.8)
. Совокупность линий
(1.8)
. Совокупность линий ![]() при заданной
при заданной ![]() образует спектр комбинационного
рассеивания.
образует спектр комбинационного
рассеивания.
По аналогии со стоксовым и антистоксовым испусканием имеем стоксовые линии рассеивания
![]() (1.9)
– стоксовые
линии рассеивания
(1.9)
– стоксовые
линии рассеивания
![]() (1.10)
– антистоксовые
линии рассеивания
(1.10)
– антистоксовые
линии рассеивания
Для атомных систем, находящихся в основном состоянии в комбинационном рассеивании получаются только стоксовые линии, соответствующие переходам с основного уровня на возбуждённые. В дальнейшем говоря о рассеивании будем иметь в виду комбинационное рассеивание.
1.3.3. Электрические способы возбуждения
В качестве источников света широко применяются различные типы газового разряда, в том числе искровой и дуговой разряды.
Nβ: При прохождении электрического тока через газы возбуждение происходит благодаря столкновениям между частицами. Причём особенно существенным является возбуждение электрическим ударом. Электроны, ускоряясь в электрическом поле, приобретают кинетическую энергию, которую они затем отдают при столкновениях тяжёлым частицам (атомам и молекулам), возбуждая их. Возбуждение может происходить, когда кинетическая энергия электрона больше либо равна энергии возбуждения ΔE.
В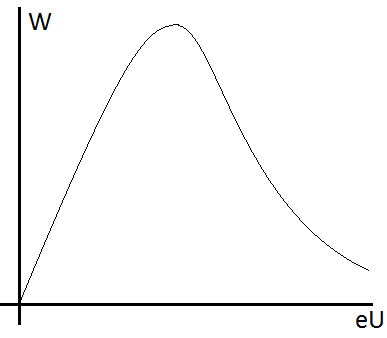 ероятность
возбуждения пропорциональна доле
столкновений (из общего числа столкновений
электронов с частицами), при котором
происходит возбуждение. Эта вероятность
представляет функцию энергии электрона,
которая при увеличении энергии сначала
возрастает, достигает максимума, и потом
спадает. Соответствующую функцию
называют функцией
возбуждения.
В простейшем случае при возбуждении
атомов электронными ударами эта функция
может быть расчитана.
ероятность
возбуждения пропорциональна доле
столкновений (из общего числа столкновений
электронов с частицами), при котором
происходит возбуждение. Эта вероятность
представляет функцию энергии электрона,
которая при увеличении энергии сначала
возрастает, достигает максимума, и потом
спадает. Соответствующую функцию
называют функцией
возбуждения.
В простейшем случае при возбуждении
атомов электронными ударами эта функция
может быть расчитана.
Метод
электронного удара широко применяется
для нахождений энергии возбуждения
уровней атомов и молекул. На опыте
определяют потенциал
возбуждения Ui,
при котором электрон отдаёт частицам
энергию. Соответствующие энергии
возбуждения ![]() находят из условия:
находят из условия:
![]() (1.11)
– условие для потенциала возбуждения
(1.11)
– условие для потенциала возбуждения
Методом
электрического удара определяют на
опыте потенциалы
ионизаии
атомов и молекул и потенциалы диссоциации
молекул.
Т.е. значения Ui
в формуле (1.11),
при которых ΔE
= Wионизации,
где Wион
– энергия отрыва электрона или энергия
ионизации. Или ![]() ,
где Wдисс
– энергия разрыва молекулы на части
или энергия диссоциации.
,
где Wдисс
– энергия разрыва молекулы на части
или энергия диссоциации.
1.4. Деление спектроскопии по свойствам излучения
1.4.1. Предмет и задачи спектроскопии
Предметом спектроскопии является изучение спектров атомных систем – спектров испускания, поглощения и рассеивания.
Задача спектроскопии: определение на основе изучения спектров характеристик уровня атомных систем и характеристик переходов с излучением между уровнями энергии.
В результате решения этой задачи получают ценную информацию о строении микроскопических частиц (атомов и молекул), и об агрегатном состоянии вещества.
Спектроскопия сыграла очень большую роль в развитии атомной физики. Спектроскопия, определяя для атомов и молекул характеристики уровней энергии и оптических переходов между ними, представляет теоретическую основу атомного и молекулярного спектрального анализа. В настоящее время спектроскопические исследования охватывают большой круг вопросов, а ряд разделов спектроскопии выделился в самостоятельные направления: астрофизические приложения спектроскопии, учение о люминесценции, резонансные методы, и так далее.
Общие положения спектроскопии справедливы для разных типов уровней энергии различных атомных систем, и для переходов, для которых частоты излучения могут различаться на много порядков. Исходя из этого, можно разбить спектроскопию на разделы. Подобное деление можно произвести:
В соответствии со свойствами электромагнитного излучения, отличающимися для различных диапазонов длин волн.
В соответствии со свойствами атомных систем, дающих спектры в зависимости от природы этих систем и от типов уровней энергии.
