
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
9.5 Электронные спектры
В молекулах внешние электроны также могут переходить на более высокие уровни. Спектры молекул имеют 2 важных отличия от атомных.
Во-первых, оптические электроны в молекулах находятся в другом состоянии, чем в атомах, т.к. они участвуют в образовании хим. связи. Вторая особенность связана с расщеплением любого электронного уровня на небольшое число простых. Группе простых уровней соответствует одно и то же электронное состояние, но разная энергия колебательного и вращательного движения молекулы. Любой электронный переход совершается между двумя простыми уровнями. Это приводит к появлению полос, которые имеют сложную колебательную вращательную структуру.
Электронные спектры можно получить для веществ, находящихся в любом агрегатном состоянии. При работе с газообразными веществами отчетливо видны колебательная и вращательная структура полос (рис 5). При работе с жидкими и твердыми телами вращательная структура электронных полос исчезает, а колебательная частично остается.
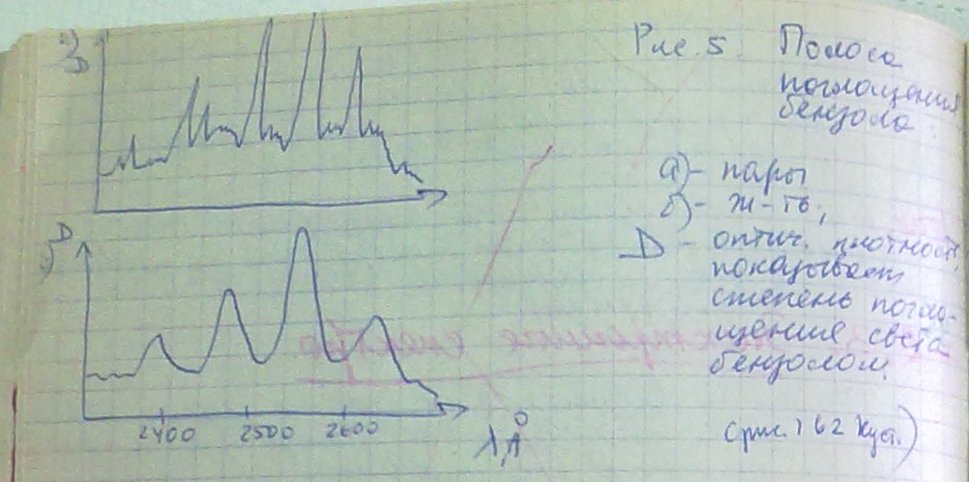
Внешние электроны обычно связано только с двумя атомами, между которыми они образуют хим.связь. Любая пара атомов, связанных такими электронами, имеет вполне определённый спектр поглощения. Он сохраняется постоянным в любых соединениях, в которые входит эта пара атомов.
Наиболее интересны переходы, связанные с возбуждением π-электронов, т.к. они лежат в видимой или УФ-областях спектра, тогда как возбуждение δ-связей соответствует переходам в области вакуумного ультрафиолета.
В ряде соединений часть внешних электронов связана с несколькими атомами, напр, в молекуле бензола с шестью атомами углерода. В этом случае электронные термы определяются строением всей молекулы или той её части, которая имеет общие электроны.
Простые и сложные группы атомов с постоянным спектром часто называют хромофорами.
Положение и интенсивность полос в спектре хромофоров остаются постоянными только при отсутствии взаимодействия. В этом отношении электронные спектры менее удобны для обнаружения определенных групп атомов, чем колебательные.
Интенсивность электронных полос поглощения обычно гораздо больше, чем колебательных. Очень многие важные органические и неорганические соединения имеют интенсивные полосы в удобных для работы ближней и средней УФ и видимой области спектра.
9.6 Аппаратура ик-спектроскопии.
Современный 2-х лучевой ИК-спектрофотометр состоит из 5 основных элементов:
1) источник излучения
2) кюветное отделенье
3) фотометр
4) монохрометор
5) приемник
Оптическая схема - на рисунке 6.
1)Источник излучения
Источником сплошного излучения в ИК области служат тв. тела при температуре 1000-1800 °С. Обычно ими служат штифты Нернста или Глобара, нагреваемые эл.током. Штифт Нернста изготовляется из окислов циркония, тория и церия и связующего вещества. Штифт Глобара представляет собой небольшой стержень из карбида кремния. Максимум излучения Глобара приходиться на область 5500-5000 см-1. Штифт Нернста имеет максимум энергии излучения в области ≈7100 см-1. Излучение источника разделяется на 2 пучка зеркалами М1 и М2. Оба пучка – пучок сравнения и пучок образца – фокусируются в кюветном отделении зеркалами М3 и М4.
