- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
8.2. Явление Штарка для атомов в общем случае.
В общем случае для атомов получается квадратичное явление Штарка – величина расщепления уровней, а следовательно, и спектральных линий, пропорциональна квадрату E.
Поляризуемость атома α, характеризующая способность электронов смещаться относительно ядра под действием поля и определяющая по формулам (8.2) и (8.3) индуцированный дипольный момент и дополнительную энергию в поле, зависит только от абсолютного значения |m| квантового числа m. Согласно квантовомеханическому расчету она выражается приближенной формулой:
![]() (8.4)
(8.4)
Дополнительная энергия в электрическом поле равна:
![]() (8.5)
(8.5)
Таким
образом, при заданном E
смещение подуровней с |m| не равном нулю
относительно подуровня m=0 пропорционально
![]() .
Число подуровней равно числу возможных
значений |m|, даваемых формулами (*) и
(**). При отсутствии вырождения (J=0, m=0)
формула (8.5) определяет смещение
невырожденного уровня.
.
Число подуровней равно числу возможных
значений |m|, даваемых формулами (*) и
(**). При отсутствии вырождения (J=0, m=0)
формула (8.5) определяет смещение
невырожденного уровня.
Так как поляризуемость атома тем больше, чем слабее электроны связаны с ядром, т.е. чем сильнее они возбуждены, то штарковское расщепление для более высоких уровней больше. Однако даже для высоких уровней абсолютная величина расщепления мала, составляя даже в сильных внешних полях лишь доли .
Картина штарковского расщепления спектральных линий определяется величиной расщепления уровней и правилами отбора. Так же, как и в явлении Зеемана, имеют место правила отбора
![]() .
.
И
при
![]() получаются π – составляющие, соответствующие
дипольному моменту, параллельному полю,
а при
получаются π – составляющие, соответствующие
дипольному моменту, параллельному полю,
а при
![]() -
–составляющие,
соответствующие дипольному моменту,
перпендикулярному полю.
-
–составляющие,
соответствующие дипольному моменту,
перпендикулярному полю.
Так как уровни расщепляются несимметричным образом (см. (8.5)), картина штарковского расщепления также получается несимметричной; это характерно для квадратичного явления Штарка.
Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
Молекулярный спектральный анализ в ИК и УФ областях спектра позволяет быстро при малых количествах образца определить его природу, проводить сравнительные исследования, однозначно определять индивидуальность вещества, количественное содержание смеси.
9.1. Строение молекулы
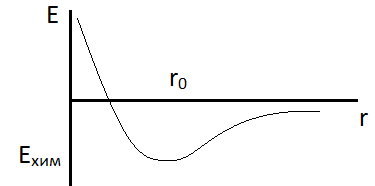
Основной вид связи атомов в молекуле – ковалентная связь. Она образуется за счёт электронов, принадлежащих одновременно обоим атомам. Для любой такой связи существует определённое равновесное состояние r0 между атомами.
Минимум энергии взаимодействия Ехим – энергия образования химической связи и энергия диссоциации молекулы. Молекулы ковалентных соединений имеют строго постоянную структуру. Положение любого атома в них закреплено по отношению к другим атомам.
Ковалентная связь может так же образовываться несколькими парами электронов. Пары электронов, образующие такие связи, не одинаковы: первая пара занимает все свободные места в самой глубокой электронной оболочке, в которой могут находиться только два электрона с разными спинами. Эти электроны называются σ-электроны. Простою ковалентную связь называют σ-связями. Следующие пары образуют оболочку с большей энергией, аналогично π-электронам в атомах. Такие электроны называют π-электроны. В молекулах с одинаковыми атомами оба атома удерживают электроны с одинаковой силой. Электронная оболочка расположена симметрично относительно обоих атомов. Но если ковалентная связь образована двумя разными атомами, то электронная пара смещена в сторону атома, который сильнее притягивает электроны.
В таких молекулах 1 атом оказывается заряженным более отрицательно. Такая молекула является диполем. Мерой разделения заряда служит так называемый дипольный момент, определяемый произведением расстояния между центрами распределения положительного и отрицательного зарядов на величину заряда.
Величина дипольного момента имеет большое значение, так как она определяет взаимодействие с фотоном и поглощение света.