
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
5.2. Общая характеристика нормальной связи.
Рассмотрим случай двух электронов. Для них:
![]() ,
,
![]() ,
,
![]() .
т.к.
.
т.к.
![]() ,
то S=0,
1.
,
то S=0,
1.
S=1 - параллельная ориентация спинов,
S=0 - антипараллельная.
Число возможных ориентаций вектора S по отношению к другому вектору или внешнему полю 2S+1. Это число
χ![]() -
мультиплетность.
-
мультиплетность.
При S=0 имеем χ=1, и соответствующие уровни называются синглетными, или одиночными.
При S=1, χ=3, и уровни называются триплетными.
Конфигурация
SS означает:
![]() и
и
![]()
Конфигурация
dp:
![]() и
и
![]() и т.д.
и т.д.
Совокупность
уровней с заданными L и S называется
мультиплетным термом.
("терм" - это также название для
обозначения абсолютной величины энергии
в
![]() ,
отсчитываемой от границы ионизации).
,
отсчитываемой от границы ионизации).
Для конфигураций pp, dp и fp имеем триады термов SPD, PDF и DFG,
для конфигураций dd и fd - пентады термов PDFGH и PDFGH.
для ff - гептада термов SPDFGHI.
Расположение мультиплетных термов определяется следующими правилами:
1. Положение термов определяется прежде всего значением S, т.е. мультиплетностью χ=2S+1. Термы лежат для данной конфигурации тем глубже, чем больше S, т.е. чем больше мультиплетность.
2. Положение термов зависит при заданном S от L. термы с большими L лежат глубже, чем термы с меньшими L.
Т.е. для электронной конфигурации триплетные термы лежат глубже синглетных, а из триплетных термов глубже лежат уровни с наибольшими L.
Например, для конфигурации 2p4p углерода порядок термов, начиная с самых глубоких, таков:
3D, 1P, 3S, 3P, 1D, 1S.
Если конфигурации более двух электронов, то, для
S=![]() (3 электрона,
(3 электрона,
![]() )
χ =2S+1=2 — дублеты,
)
χ =2S+1=2 — дублеты,
S=![]() (
(![]() )χ
=2S+1=4
— квартеты.
)χ
=2S+1=4
— квартеты.
Тема 6: Рентгеновские спектры.
6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
Рентгеновские спектры возникают при возбуждении электронов внутренних оболочек атома. Их отличие от оптических спектров определяется тем, что эти оболочки полностью заполнены, и поэтому переход электронов из одной оболочки в другую невозможен, пока в ней не появится свободное место.
Определение: Рентгеновский спектр поглощения соответствует переходу электрона из внутренней оболочки на непрерывные уровни, примыкающие к границе ионизации.
Таким образом, при поглощении фотона атом ионизируется. Т.к. на внутренних оболочках электрон связан очень прочно, энергия фотона должна быть очень большой, в отличие от энергии, необходимой для ионизации, напр., атома водорода (которая ~ 13,6 eV). Для ионизации атомов тяжелых элементов за счет вырывания электрона из оболочки 1S требуется энергия ~ 105 eV.
Определение: Дискретные рентгеновские спектры испускания (т.н. характеристические спектры) возникают при переходе электрона из более внешней оболочки на свободное место в более внутренней оболочке.
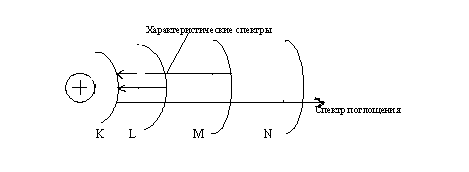
В рентгеновской спектроскопии принято слои с n=1, 2, 3, 4, 5, 6... обозначать буквами K, L, M, N, O, P ...
Совокупность линий, возникающих при переходах электрона на данный слой, образуют серии: K-серию — переход на n=1
L-серию — переход на n=2 и т.д.
Любая серия, за исключением К-серии, состоит из подсерий:
L-серия из подсерий:
LI - переход на 2S
LII и LIII - переход на дублетный уровень 2p: 2p1/2 и 2p1/2
М-серия из подсерий: MI — на 3S
MII
}на 3P1/2 и 3P3/2
MIII
MIV
}на 3D3/2 и 3D5/2
MV
Линии данных подсерий из-за уменьшения расстояния уровней M, N, О... сходятся к соответствующему краю - границе серии, соответствующей ионизированному состоянию.
Отдельные
линии
серии принято обозначать греческими
буквами
![]() ,
,
![]() ,
,
![]() с индексами.
В частности, первые две линии К-серии
(переходы K
- L) обозначаются
с индексами.
В частности, первые две линии К-серии
(переходы K
- L) обозначаются
![]() и
и
![]() (т.к. существуют дублеты уровня 2p) и т.д.
(т.к. существуют дублеты уровня 2p) и т.д.
Самой важной особенностью рентгеновских спектров, связанной со свойствами внутренних оболочек, является монотонное изменение частот переходов и длин волн аналогичных линий испускания при изменении порядкового номера Z. Для аналогичных линий с увеличением Z частоты постепенно увеличиваются, а длины волн уменьшаются. Если для легких электронов характеристический спектр лежит в области мягких рентгеновских лучей, то для тяжелых элементов К-серия лежит в области очень жестких рентгеновских лучей.
Линии определенной серии могут появляться, когда заполняется слой, из которого электрон переходит в более внутренний слой. Поэтому сперва, при заполнении L-слоя (n=2) появляется К-серия, затем, при заполнении М-слоя (n=3), появляется L-серия и т.д.
