
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
4.2. Электронные слои и оболочки и их заполнение.
Электроны с заданным
n
образуют определённый слой,
содержащий при полном его заполнении,
![]() электронов.
электронов.
Электроны с
различными
при заданном n
образуют оболочку,
содержащую, при полном её заполнении,
![]() эквивалентных электронов.
эквивалентных электронов.
В соответствии с таблицей 6.1 (?!) имеем такую картину:
Самый внутренний слой соответствует n=1 и состоит только из одной оболочки
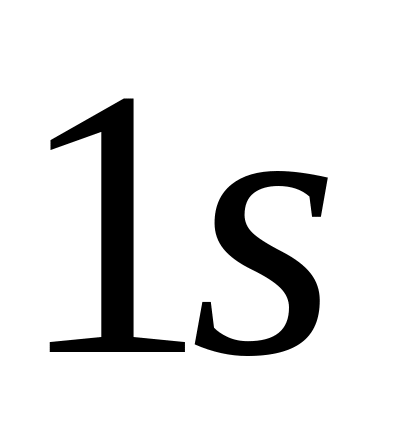 .
Он заполняется 2-мя электронами.
.
Он заполняется 2-мя электронами.Следующий слой n=2, состоит из 2-х оболочек
 и
и
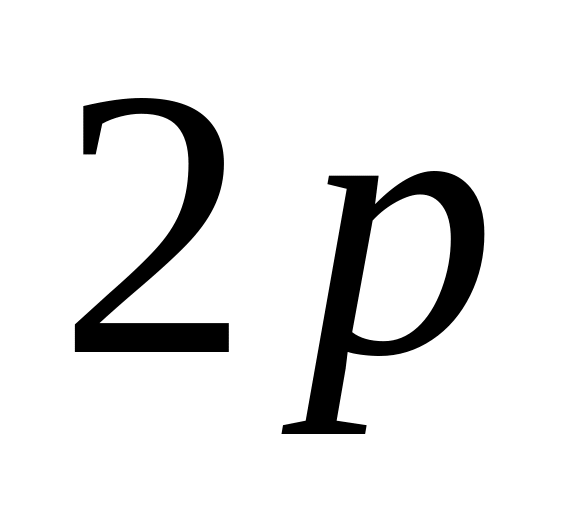 и заполняется 8-ю электронами.
и заполняется 8-ю электронами.Последующие слои n=3, 4, 5 … состоят из 3-х, 4-х, 5-ти оболочек, заполненяются 18, 32, 50…электронами.
Слои с n=1, 2, 3, 4, 5, 6 часто называют K, L, M, N, O, P – слоями.
Электроны стремятся
заполнить состояния с наименьшей
энергией. Энергия электрона тем меньше,
чем меньше n
(из (6.4)); с уменьшением n
не только уменьшается знаменатель
![]() ,
но и увеличивается
,
но и увеличивается
![]() ,
т.к. эффективный заряд ядра
,
т.к. эффективный заряд ядра
![]() будет больше из-за уменьшения экранирования.
Слои заполняются с n=1,
2…
будет больше из-за уменьшения экранирования.
Слои заполняются с n=1,
2…
Заполнение слоёв с последовательными значениями n определяет общую структуру периодической системы элементов.
Начало любого
периода (горизонтальная строка)
соответствует началу заполнения
соответствующего слоя. В начале
периодической системы происходит полное
заполнение слоёв (это 1-й и 2-й периоды,
![]() и 8).
и 8).
Дальнейшее
заполнение слоёв осложняется тем, что,
наряду с зависимостью энергии электрона
от n,
существенна и её зависимость от
![]() при заданном n
и поэтому нужно
учитывать
не только
порядок заполнения слоёв, но и порядок
заполнения оболочек.
при заданном n
и поэтому нужно
учитывать
не только
порядок заполнения слоёв, но и порядок
заполнения оболочек.
Как уже знаем, в
сложных атомах энергия электрона тем
меньше при заданном n,
чем меньше
.
Эффективный заряд
,
входящий в (6.4) (?!), при заданном n
увеличивается с уменьшением
,
а постоянная экранирования
![]() уменьшается; s-электроны
экранируют меньше, чем p–электроны;
p-электроны
меньше, чем d–электроны,
т.е.
уменьшается; s-электроны
экранируют меньше, чем p–электроны;
p-электроны
меньше, чем d–электроны,
т.е.
![]()
Вследствие того, что энергия электронов при заданном n тем меньше, чем меньше , сначала заполняется оболочка ns, затем np, nd, nf и т.д.
В силу зависимости
энергии от
при
![]() ,
электроны с большими n
и меньшими
оказываются связанными прочнее, чем
электроны с меньшими n
и большими
.
Электрон 4s оказывается связанным
прочнее, чем электрон 3d,
электрон 5s
прочнее, чем электроны 4d
и 4f,
а 6s
прочнее 5d,
5f,
5g
и 4f.
,
электроны с большими n
и меньшими
оказываются связанными прочнее, чем
электроны с меньшими n
и большими
.
Электрон 4s оказывается связанным
прочнее, чем электрон 3d,
электрон 5s
прочнее, чем электроны 4d
и 4f,
а 6s
прочнее 5d,
5f,
5g
и 4f.
Это приводит к тому, что действительный порядок заполнения слоёв и оболочек оказывается следующим:
1


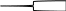 s²;
2s²2p6
; 3s²3p6
; 4s²3d104p6;
5s²4d¹05p6;
6s²4f¹45d¹06p6…
s²;
2s²2p6
; 3s²3p6
; 4s²3d104p6;
5s²4d¹05p6;
6s²4f¹45d¹06p6…
2 8 8 18 18 32
Периоды |
Оболочки |
1 2 3 4 5 6 7 |
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d |
Тогда для периодической системы можно расписать:
В длинных периодах 4 и 5 имеется заполнение “более внутренней” (с меньшим n) оболочки d десятью электронами, а в 6-ом периоде, кроме того, оболочки f 14-тью электронами. Заполнение оболочки nd приводит к появлению характерных групп переходных элементов от Sc до N (в 4 периоде, n=3), от Y до Pd (в 5 периоде, n=4) и от Ln до Pt (в 6-ом периоде, n=5), а заполнение оболочки 4f – к появлению группы редких земель – лантаноидов, состоящей из 14 элементов. В 7-ом периоде происходит заполнение оболочки 5f; ей соответствует вторая редкоземельная группа – актиниды, в которую входят урановые и трансурановые элементы.
Итак, благодаря тому, что электроны с меньшим , связаны более прочно, чем электроны с большим , даже если для них n больше, порядок заполнения оказывается более сложным.
