
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
Тема 4. Электронные оболочки атомов и периодическая система элементов.
4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
В сложном атоме, содержащем 2 и более электронов, эти электроны взаимодействуют между собой, и поэтому, нельзя считать, что каждый электрон двигается в поле ядра независимо от всех остальных. Однако приближенно действие всех остальных электронов на данный электрон можно заменить некоторым усредненным, эффективным полем, обладающем сферической симметрией и убывающем с увеличением расстояния r рассматриваемого электрона от ядра. Дополнительная потенциальная энергия электрона Uдоп в этом поле будет функцией от r, и полная потенциальная энергия электрона в поле ядра и остальных электронов запишется в виде:
![]() (4.1)
(4.1)
С
точки зрения наглядных представлений
все остальные электроны образуют
сферически симметричное электронное
облако, и на электрон, находящийся на
расстоянии r
от ядра, действует, наряду с зарядом
ядра z,
заряд
![]() всех
электронов, расположенных внутри сферы
радиуса r,
что приводит к экранированию
ядра электронами.
всех
электронов, расположенных внутри сферы
радиуса r,
что приводит к экранированию
ядра электронами.
Потенциал
![]() можно представить:
можно представить:
![]() , (4.2)
, (4.2)
где
![]() -
функция расстояния, характеризующая
экранирование ядра электронами. С
помощью (6.2) формула (6.1) запишется в виде:
-
функция расстояния, характеризующая
экранирование ядра электронами. С
помощью (6.2) формула (6.1) запишется в виде:
![]() (4.3)
(4.3)
где
![]() -
эффективный заряд ядра, действующий на
электрон на расстоянии r.
Это такой заряд ядра, при котором для
силы, обратно пропорциональной квадрату
расстояния (кулоновской силы), потенциал
на данном расстоянии r
равен U(r).
-
эффективный заряд ядра, действующий на
электрон на расстоянии r.
Это такой заряд ядра, при котором для
силы, обратно пропорциональной квадрату
расстояния (кулоновской силы), потенциал
на данном расстоянии r
равен U(r).
Функция
экранирования
с
расстоянием возрастает от
![]() при r
=0 до постоянного значения на
при r
=0 до постоянного значения на
![]() -
ти. При r
-
ти. При r![]() на
электрон будет действовать поле ядра
за вычетом поля всех электронов, кроме
одного, и для нейтрального атома
на
электрон будет действовать поле ядра
за вычетом поля всех электронов, кроме
одного, и для нейтрального атома
![]() .
.
Электрон в сферически симметричном поле можно характеризовать набором квантовых чисел:
![]()
![]()
![]()
![]()
Рассмотренное приближение (внешний электрон + атомный остаток) называют одноэлектронным приближением.
Очень важен вопрос о зависимости энергии электрона от квантовых чисел. Энергия будет теперь зависеть не только от n, но и от . Для поля типа (6.3), убывающего с расстоянием более быстро, чем кулоновское (с увеличением r одновременно уменьшается Z(r), стоящее в числителе), энергия электрона тем меньше при заданном n, чем меньше .
Физическая
причина подобной зависимости состоит
в том, что электоны с меньшим
подходят ближе к ядру, где
![]() Z(r)
больше, что увеличивает их энергию
связи. Подробно мы рассмотрим этот
вопрос дальше.
Z(r)
больше, что увеличивает их энергию
связи. Подробно мы рассмотрим этот
вопрос дальше.
Энергию электрона как функцию n и можно представить в виде, аналогичном формуле (5.3):
![]() (4.4)
(4.4)
где
введён
![]() -эффективный з-д. Как правило,
<
Z
и его записывают в виде:
-эффективный з-д. Как правило,
<
Z
и его записывают в виде:
![]() (4.5)
(4.5)
где
![]() – постоянная экранирования, являющаяся
функцией от n
и от
.
– постоянная экранирования, являющаяся
функцией от n
и от
.
Рассмотрим теперь сложный атом с числом электронов N. Его состояние в одноэлектронном приближении будет характеризоваться совокупностью квантовых чисел:
![]() ;
;
![]() ;
… ;
;
… ;
![]() .
.
Если атом содержит 1 электрон, этот электрон может находиться в любом состоянии, для которого:
n=1,2,3…;
=0,1,2…n-1;
![]() =
,
-1,…,-
;
=
,
-1,…,-
;
![]() .
.
Для атома содержащего два и более электронов, возможные состояния отдельных электронов определяются принципом Паули:
в
атоме не может быть двух электронов в
одинаковых состояниях, т.е. не может
быть двух электронов, характеризуемых
одинаковыми наборами квантовых чисел
![]() ,
,
,
,
,
,
![]() .
.
Любые два электрона должны отличаться значением хотя бы одного из 4-х квантовых чисел.
Принцип Паули позволяет определить возможное число электронов в атоме, обладающих заданными значениями определённых квантовых чисел.
Если задано значение n и , то, согласно формуле gl = 2(2•l+1), возможны 2(2 +1) состояний, отличающихся значениями и . Следовательно, в атоме может быть не более
 электронов с заданными
и
.
электронов с заданными
и
.
Т.О., при заданном в атоме может иметься:
2(2•0+1)=2 S-электрона ( =0),
2(2•1+1)=6 P-электронов ( =1) и т.д.
Если задано значение , то возможны
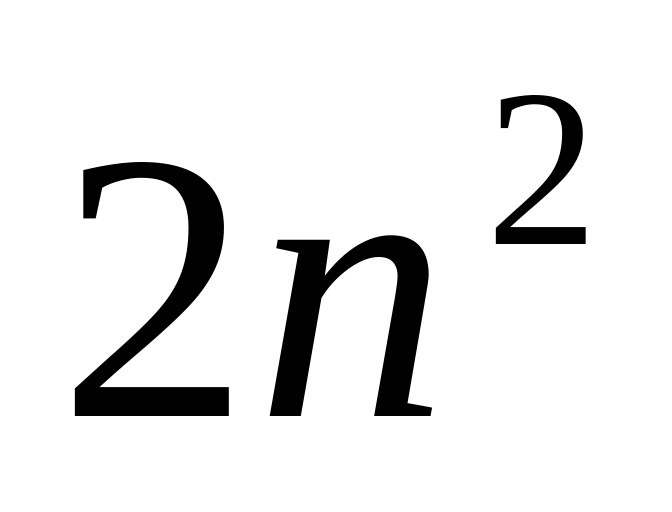 состояний, отличающихся значениями
,
и
(см. (5.2)) следовательно, в
атоме может быть не более
электронов с заданным n,
т.е. может иметься 2, 8, 18, 32… электронов
с n=1,
2, 3, 4…
состояний, отличающихся значениями
,
и
(см. (5.2)) следовательно, в
атоме может быть не более
электронов с заданным n,
т.е. может иметься 2, 8, 18, 32… электронов
с n=1,
2, 3, 4…
n=1 |
|
|
n=2 |
|
|
n=3 |
|
|
n=4 |
|
|
n=5 |
|
|
… |
… |
… |
Возможные числа эквивалентных электронов в таблице 1
Сумма показателей в горизонтальном ряду даёт полное число электронов 2n2, т.е. 2, 8, 18…
Совокупность
значений n
и
для
всех N
электронов в атоме
![]()
![]() ,
,
![]()
![]() ,
…,
,
…,![]()
![]() характеризует
электронную
конфигурацию.
характеризует
электронную
конфигурацию.
