- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
Формула Бора для атома водорода является частным случаем общих формул для уровней энергии одноэлектронных атомов. Эти формулы были впервые получены Бором в 1913 году на основе модельных представлений его теории, а затем выведена последовательным квантово-механическим методом Шредингером в 1926 году. Они имеют вид:
![]() (n=1.2.3…)
(3.5.1)
(n=1.2.3…)
(3.5.1)
![]() ,
(3.5.2)
,
(3.5.2)
где постоянная Ридберга:
![]() ,
,
 (3.5.3
) - приведенная масса электрона и ядра.
(3.5.3
) - приведенная масса электрона и ядра.
Введением приведенной массы учитывается тот факт, что в атоме движется не только электрон, но и ядро, и движение происходит вокруг общего центра масс.
Уровни
энергии и частоты переходов для членов
изоэлектронного ряда отличаются
масштабом, который увеличивается
пропорционально
![]() .
R согласно (5.5.3) мало меняется с массой
ядра
.
R согласно (5.5.3) мало меняется с массой
ядра
![]() ,
то есть этот масштаб определяется
множителем
,
то есть этот масштаб определяется
множителем
![]() ,
т.е. возрастает пропорционально
.
Спектральные
серии для водородоподобных ионов
аналогичны спектральным сериям атома
H, только смещены в коротковолновую
область.
,
т.е. возрастает пропорционально
.
Спектральные
серии для водородоподобных ионов
аналогичны спектральным сериям атома
H, только смещены в коротковолновую
область.
Несмотря
на малость отличия приведенной массы
m
от массы электрона
![]() ,
все же необходимо учитывать зависимость
m
от массы ядра M.
Значения R
несколько отличаются как для разных
элементов, так и для изотопов одного
элемента. Отличия составляют сотые доли
процента. Однако этого достаточно для
того, чтобы их измерить. Дважды в истории
развития физики они сыграли существенную
роль: первый раз, когда Бору в 1913 году
удалось истолковать некоторые спектральные
серии, приписываемые водороду, как серии
ионизированного
,
все же необходимо учитывать зависимость
m
от массы ядра M.
Значения R
несколько отличаются как для разных
элементов, так и для изотопов одного
элемента. Отличия составляют сотые доли
процента. Однако этого достаточно для
того, чтобы их измерить. Дважды в истории
развития физики они сыграли существенную
роль: первый раз, когда Бору в 1913 году
удалось истолковать некоторые спектральные
серии, приписываемые водороду, как серии
ионизированного
![]() ;
и второй раз в 1932 году, когда по наличию
слабых спутников линий серии Бальмера
был открыт тяжелый водород - дейтерий.
;
и второй раз в 1932 году, когда по наличию
слабых спутников линий серии Бальмера
был открыт тяжелый водород - дейтерий.
3.6. Характеристика стационарных состояний одноэлектронного атома.
С точки зрения модельных представлений Бора, стационарного состояния соответствуют движению электрона по определенным орбитам.
Бор получил радиус круговой орбиты
![]() (формула
Бора для радиуса круговой орбиты)
(формула
Бора для радиуса круговой орбиты)
 Т.е.
любому уровню энергии
Т.е.
любому уровню энергии
![]() соответствует своя орбита.
соответствует своя орбита.
При более общем решении задачи об одноэлектронном атоме, на основе модельных представлений Бора, получается движение по эллиптическим орбитам.
Эллиптические орбиты, соответствующие n = 1, 2, 3 показаны на рис.1.
При n=1 возможна лишь круговая орбита, а при n=2, 3 - круговая и эллиптические. Причем, чем меньше орбитальный момент, тем эллипс более вытянут и тем меньше минимальное расстояние, на которое электрон подходит к ядру.
П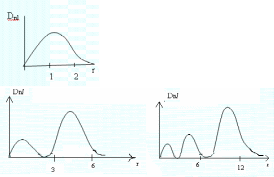 ерейдем
теперь к квантовомеханической
характеристике стационарных состояний
одноэлектронного атома.
ерейдем
теперь к квантовомеханической
характеристике стационарных состояний
одноэлектронного атома.
Решение
квантово механической задачи приводит
к формуле (3.5.1) для уровней энергии и
позволяет характеризовать вырожденные
состояния с различными
![]() и
и
![]() (при заданном n)
наглядным образом при помощи распределения
электронной плотности. Заряд электрона
при этом рассматривается как непрерывно
распределенный по объёму атома с
некоторой плотностью
(при заданном n)
наглядным образом при помощи распределения
электронной плотности. Заряд электрона
при этом рассматривается как непрерывно
распределенный по объёму атома с
некоторой плотностью
![]() т.о., что полный заряд равен e,
т.е.
т.о., что полный заряд равен e,
т.е.
![]() .
.
Т.е. электрон нельзя локализовать, и любому состоянию сопоставляется пространственное распределение электронной плотности - некое электронное облако.
П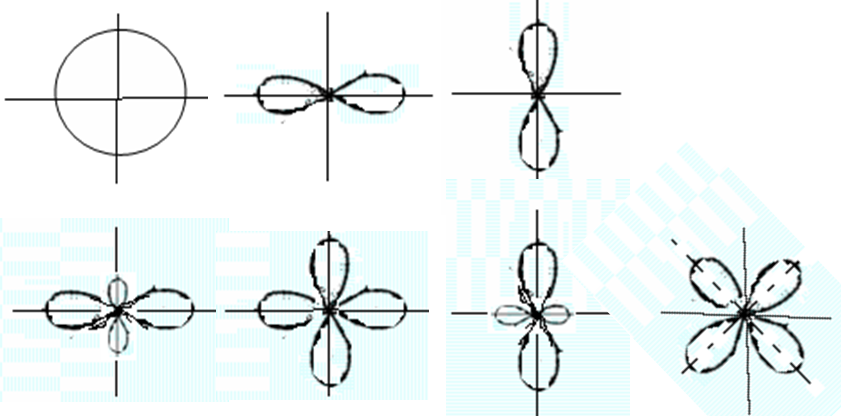 редставление
об электронном облаке правильнее
отражают свойства электрона в атоме,
чем модельные представления теории
Бора.
редставление
об электронном облаке правильнее
отражают свойства электрона в атоме,
чем модельные представления теории
Бора.
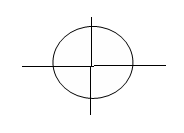
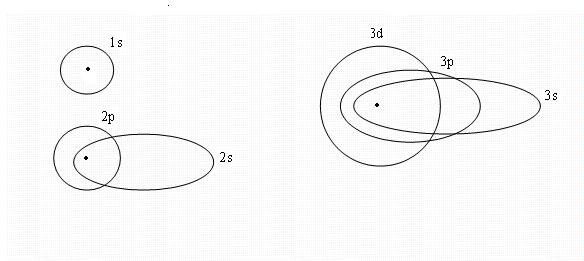
Для состояний одноименного атома распределение в первую очередь зависит от , при =0 оно является сферически симметричным и имеет максимум в начале координат (где находится ядро); для >0 электронная плотность в начале координат равна нулю. С увеличением n плотность облака уменьшается, и оно занимает всё большую область. Можно задать так называемое радиальное распределение электронной плотности-рис.2.
При = n-1, т.е. для состояний 1s, 2p, 3d получается только один максимум. С уменьшением число максимумов при заданном n увеличивается, причем первый максимум приближается к ядру, а последний удаляется от него, т.е. распределение электронной плотности растягивается вдоль радиуса. Это соответствует переходу от круговых орбит к эллиптическим (рис.2).
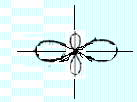
Угловое
распределение электронной плотности
характеризуется функцией ![]() ,
оно показано на рисунках ниже.
,
оно показано на рисунках ниже.
Распределение
электронной плотности играет важную
роль при рассмотрении вопросов
взаимодействия атомов, в особенности
вопросов образования химической связи
между атомами в молекуле.