
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
3.3. Правила отбора для одноэлектронных атомов.
Спектральные переходы могут происходить не между всеми парами уровней энергии. Переходы имеют место лишь при выполнении определенных условий – правил отбора.
Переходы, которые удовлетворяют правилам отбора, называют разрешенными, вероятность остальных очень низкая и они называются запрещенными.
Для главного квантового числа n возможны любые его изменения, что приводит к появлению серий, высокие члены которых могут соответствовать очень большим изменениям
![]()
Правил отбора по n не уществует.
Для орбитального квантового числа имеет место правило отбора:
![]()
С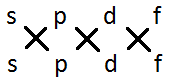 огласно
правилу отбора (3.3.1) s-состояния
комбинируют только с p-состояниями,
p-состояния
комбинируют как s-,
так и с d-состояниями,
d-состояния
комбинируют как с p,
так и с f-состояниями
и т.д. Это можно представить в виде
схемы:
огласно
правилу отбора (3.3.1) s-состояния
комбинируют только с p-состояниями,
p-состояния
комбинируют как s-,
так и с d-состояниями,
d-состояния
комбинируют как с p,
так и с f-состояниями
и т.д. Это можно представить в виде
схемы:
Для
орбитального магнитного квантового
числа
![]() правило отбора имеет вид:
правило отбора имеет вид:
![]()
т.е.
![]() может либо сохранять своё значение,
либо менять его на
может либо сохранять своё значение,
либо менять его на
![]() 1.
1.
3.4. Тонкая структура уровней энергии и спектральных линий.
Наличие спина электрона обуславливает для одноэлектронных атомов тонкую структуру уровней энергии и тонкую структуру спектра линий, получающихся при переходах между этими уровнями.
Рассмотрим
характер уровней энергии при учёте
спин-орбитального взаимодействия.
Благодаря спин-орбитальному взаимодействию
орбитальный момент
складывается со спиновым моментом ![]() в полный момент:
в полный момент:
![]()
Его величина определяется внутренним квантовым числом j, принимающим полу целые значения
![]()
Значение
проекции ![]() вектора
вектора ![]() определяется
полным магнитным квантовым числом
определяется
полным магнитным квантовым числом ![]() ,
принимающим
,
принимающим ![]() значение от -j
до j.
значение от -j
до j.
Т.е.
получим набор еще один набор квантовых
чисел: ![]()
Для
уровня с заданными n,
и j
степень вырождения равна: ![]()
Число
независимых состояний при заданных n
и
равно ![]() .
.
Док-во:
Действительно, при ![]() получается
получается
![]() состояний, а при
состояний, а при
![]() получается
получается ![]() состояний,
т.е. всего
состояний,
т.е. всего ![]() состояний.
состояний.
Рассмотрим подробнее возможные уровни энергии атома водорода при заданном n, различающиеся значениями и j.
Согласно
(3.4.1), при ![]() ,
и получается одно значение j,
а при всех других
получается
по два значения j:
,
и получается одно значение j,
а при всех других
получается
по два значения j:
![]()
(при
![]() и j=3
/ 2, при
= 2 j
= 3/2 и j
= 5/2 и т.д.)
и j=3
/ 2, при
= 2 j
= 3/2 и j
= 5/2 и т.д.)
Общее
число уровней с различными парами
и j
равно ![]() .
При этом j
принимает n
значений, меняясь от 1/2 до n-1/2,
причем любое значение j
встречается по два раза, кроме максимального
значения, равного j=
n-1/2,
которое получается один раз (Док-во:
.
При этом j
принимает n
значений, меняясь от 1/2 до n-1/2,
причем любое значение j
встречается по два раза, кроме максимального
значения, равного j=
n-1/2,
которое получается один раз (Док-во:
![]() .
.
Каждое
значение
также встречается по 2 раза, кроме
минимального значения, равного нулю,
которое получается один раз ![]() .
.
Итак,
можем схематически изобразить уровни
энергии атома водорода с различными
значениями n,![]() ,
j
(смотри таблицу).
,
j
(смотри таблицу).
n |
|
j |
Обозн. |
4 |
3 |
7/2 |
42F7/2 |
5/2 |
42F5/2 |
||
2 |
5/2 |
42D5/2 |
|
3/2 |
42D3/2 |
||
1 |
3/2 |
42P3/2 |
|
1/2 |
42P1/2 |
||
0 |
1/2 |
42S1/2 |
|
3 |
2 |
5/2 |
32D5/2 |
|
3/2 |
32D3/2 |
|
1 |
3/2 |
32P3/2 |
|
|
1/2 |
32P1/2 |
|
0 |
1/2 |
32S1/2 |
|
2 |
1 |
3/2 |
22P3/2 |
|
1/2 |
22P1/2 |
|
0 |
1/2 |
22S1/2 |
|
1 |
0 |
1/2 |
12S1/2 |
Цифра впереди указывает значение n.
Буквами S, P, D, F обозначены значения = 0, 1, 2, 3 для атома в целом, а не для одного электрона для которого было s, p, d, f.
Для атома, имеющего лишь один электрон, орбитальный момент атома в целом и есть орбитальный момент электрона. В общем же случае атома со многими электронами орбитальный момент атома в целом является суммой орбитальных моментов отдельных электронов.
При
учете спина полный момент принимает
два значения: ![]() .
Поэтому вместо любого уровня имеем два
уровня - дублет. Это обозначается индексом
2, стоящим слева вверху. Этот
индекс дает число возможных ориентаций
спина (мультиплетность), равное в общем
случае:
.
Поэтому вместо любого уровня имеем два
уровня - дублет. Это обозначается индексом
2, стоящим слева вверху. Этот
индекс дает число возможных ориентаций
спина (мультиплетность), равное в общем
случае:
![]()
где S - значение спина для атома в целом.
В данном случае:
![]()
Индекс справа снизу указывает значение числа j. Этим индексом принято обозначать значение полного момента атома; в данном случае полный момент атома совпадает с полным моментом электрона.
Например:

