
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
Спектр атома водорода является простейшим атомным спектром. Это обусловлено тем, что атом H имеет простое строение и состоит из протона с зарядом +e и электрона с зарядом -e . Т.е. атом H - это одноэлектронная система.
Аналогичными
спектрами будут обладать все ионы - ![]() и т.д., состоящие из ядра и также из одного
электрона. Соответственно, мы будем
считать заряд ядра равным +Ze,
где Z
= 1
для H,
Z = 2
для
и т.д., состоящие из ядра и также из одного
электрона. Соответственно, мы будем
считать заряд ядра равным +Ze,
где Z
= 1
для H,
Z = 2
для ![]() ,
Z
= 3
для
,
Z
= 3
для ![]() и т.д.
и т.д.
Итак, мы будем говорить об одноэлектронном атоме, подразумевая нейтральный атом водорода и ионизированные атомы с одним электроном – водородоподобные ионы. Они вместе с атомом водорода образуют изоэлектронный ряд - т.е. ряд атомов с одинаковым числом электронов.
Состояние одноэлектронного атома характеризуется четырьмя квантовыми числами:
Главное квантовое число n принимает целые значения n = 1, 2, 3, ..., и определяет энергию стационарного состояния по формуле Бора: Еn = -R/n2.
Орбитальное квантовое число l определяет величину момента количества движения электрона относительно ядра (орбитальный момент). При заданном n оно принимает целые значения:
![]() = 0, 1, 2, 3, …, n-1,
т.е. n значений.
= 0, 1, 2, 3, …, n-1,
т.е. n значений.
Квадрат
орбитального момента равен ![]()
Состояния с различными l принято обозначать буквами:
![]() = 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
= 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
s p d f g h i k l m n o q r t
Орбитальное магнитное квантовое число
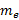 определяет величину проекции орбитального
момента на заданное направление. При
заданном
принимает целые значения:
определяет величину проекции орбитального
момента на заданное направление. При
заданном
принимает целые значения:
![]() т.е.
т.е. ![]() значений (*), или
значений (*), или ![]()
Сама проекция орбитального момента равна ħme .
Спиновое магнитное квантовое число
 определяет проекцию спина на фиксированную
ось. Принимает
два полуцелых значения:
определяет проекцию спина на фиксированную
ось. Принимает
два полуцелых значения:
![]()
Таким образом, характеристика стационарного электронного состояния атома водорода или водородоподобного иона дается набором четырех квантовых чисел:
![]()
3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
Заданному значению энергии может соответствовать одно определенное стационарное состояние или ряд (2 и более) стационарных состояний, отличающихся друг от друга какими-либо свойствами.
ОПР. Если имеется одно стационарное состояние с заданным значением энергии, то уровень энергии называется невырожденным. Если же имеется ряд таких состояний, которым соответствует одно значение энергии, то уровень энергии называют вырожденным и говорят, что эти состояния вырождены.
ОПР. Число различных независимых состояний атомной системы с одним и тем же значением энергии Еi называют степенью или кратностью вырождения.
Степень вырождения = 1 для невырожденных уровней и > 1 для вырожденных уровней.
Примером системы с невырожденными уровнями энергии является система с одной степенью свободы, совершающая гармонические колебания около положения равновесия - линейный гармонический осциллятор. Таким осциллятором можно считать 2-х атомную молекулу, в которой ядра колеблются друг относительно друга по оси молекулы вокруг некоторого равновесного положения. Согласно квантовой механике для линейного гармонического осциллятора получаются равноотстоящие невырожденные уровни энергии.
Примером системы с вырожденными уровнями энергии является электрон, движущийся под действием электрических сил при отсутствии магнитных взаимодействий, например, электрон в атоме водорода. В силу наличия у электрона спина уровни энергии электрона оказываются двукратно вырожденными.
При наличии дополнительных взаимодействий вырожденные уровни могут расщепляться: значения энергии для первоначально вырожденных состояний оказываются уже различными, и вырождение исчезает, или, как говорят, происходит снятие вырождения.
Например, для электронов в атоме Н двухкратное вырождение снимается при приложении внешнего магнитного поля. Направление маг. поля представляет выделенное направление, вдоль кот. ориентируется спин электрона, и энергия электрона уже будет зависеть от того, ориентирован ли спин параллельно или антипараллельно полю. Т. о. состояниям с параллельной и с антипараллельной ориентацией спина будут соответствовать уже различные уровни энергии.
ИТАК, Степень вырождения является весьма важной характеристикой уровней энергии.
Найдем степень вырождения уровней одноэлектронного атома. Степень вырождения определяется числом независимых состояний с данной энергией.
Рассмотрим сперва число независимых состояний при заданном значении квантового числа l.
При
заданном
мы имеем
состояния, отличающихся значениями
(из *). То есть вектор ![]() может быть ориентирован
способами.
может быть ориентирован
способами.
При
заданных![]() и
возможны два состояния, отличающихся
значениям
и
возможны два состояния, отличающихся
значениям ![]() .
Всего при заданном l
мы получаем
.
Всего при заданном l
мы получаем ![]() -
независимых состояний, т.е. степень
вырождения по
-
независимых состояний, т.е. степень
вырождения по ![]() и
уровня
энергии
с
определенным l
равна:
и
уровня
энергии
с
определенным l
равна:
![]()
Теперь
легко определить степени вырождения
уровней с
заданным главным квантовым числом n,
если учесть, что при этом
принимает значения от 0
до ![]() .
Суммируя величину
.
Суммируя величину ![]() из (**) от 0
до
получаем степень
вырождения по n:
из (**) от 0
до
получаем степень
вырождения по n:
![]()
