
- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
3. Структурный анализ по спектрам комбинационного рассеивания
Спектры комбинационного рассеивания позволяют получить дополнительные данные о колебательных состояниях в молекуле, которые вместе с данными ИК спектров поглощения устанавливают структурные элементы молекул.
Особенности получения спектров комбинационного рассеивания (по сравнению с получением ИК спектров):
Вещества в газообразном состоянии легче изучать по ИК спектрам (если газы дают эти спектры). Однако молекулы типа H2, N2, не имеющие дипольных моментов, не дают ИК спектры, и могут быть исследованы только при помощи спектров комбинационного рассеивания.
Окрашенные и мутные вещества неблагоприятны для получения спектров комбинационного рассеивания, следовательно изучаются только с помощью ИК спектров.
Спектры комбинационного рассеивания могут давать частоты в интервале 0..4000 см-1. Отсюда следует легкодоступность исследованию молекулы с колебаниями, лежащими ниже 250 см-1. В ИК области наблюдение таких колебаний затруднено.
Водные растворы могут быть вполне изучены при помощи спектров комбинационного рассеивания, так как исследование в ИК области сильно мешает спектр поглощения воды.
2.4. Общие схемы проведения спектрального анализа
2 .4.1. Эмиссионный спектральный анализ
2.4.а – схема эмиссионного спектрального анализа
2.4.б – схема абсорбционного спектрального анализа
1 – источник света, 2 – осветительная линза, 3 – кювета для анализируемой пробы, 4 – спектральный аппарат, 5 – регистрация спектра, 6 – определение λ спектральных линий или полос, 7 – качественный анализ пробы с помощью атласов и таблиц, 8 – определение интенсивностей линий или полос, 9 – количесвенный анализ пробы по градировочному графику.
Для того, чтобы вещество излучало свет необходимо передать дополнительную энергию и перевести атомы и молекулы в возбуждённое состояние. Возвращаясь в исходное состояние они отдают избыточную энергию в виде света.
При эмиссионном анализе анализируемая проба переводится в газообразное состояние путём испарения. Испарение и возбуждение осуществляется в источнике света, в качестве которых используют различные типы электрического разряда в газах: дугу, искру. Для получения разряда служат генераторы. Излучение света складывается из излучения атомов газов, присутствующих в пробе. Для анализа необходимо выделить излучение любого элемента. Это осуществляется с помощью спектральных аппаратов, в которых лучи с разными длинами волн разделяются и получаются спектры. Свет, разложенный в спектр можно рассматривать визуально или зарегистрировать с помощью фотопластинки. При качественном анализе необходимо определить, к излучению какого элемента относится та или иная линия. Для этого нужно найти λ линии по её положению в спектре, а затем с помощью таблиц определить её принадлежность тому или иному элементу. Для рассмотрения увеличенного изображения спектра на фотопластинке и определения длины волны служат спектропроекторы, измерительные микроскопы. Интенсивность спектральных линий растёт с увеличением концентрации элементов в пробе. Так, для проведения количественного анализа надо найти интенсивность одной спектральной линии определяемого элемента. Интенсивность линии измеряют по её почернению на фотографии спектра – спектрограмме. Величину почернения определяют на микрофотометрах. Связь между интенсивностью линий в спектре и концентрацией элементов в анализируемой пробе устанавливают с помощью эталонов, т.е. образцом с точно известным химическим составом. Эту связь обычно выражают в виде градуированных графиков.
В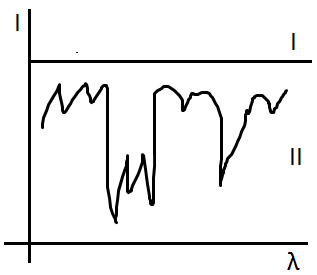 настоящее время вся система регистрации
и анализа модифицирована в одной общей
компьютеризированной системе –
анализаторе спектров.
настоящее время вся система регистрации
и анализа модифицирована в одной общей
компьютеризированной системе –
анализаторе спектров.
