- •Часть 1. Тема 1: Основные положения спектроскопии
- •1.1. Основные квантовые законы (постулаты Бора)
- •1.2. Уровни энергии и переходы между ними.
- •1.2.1. Спектр атома водорода
- •1.3. Спектры поглощения, испускания и рассеивания
- •1.3.1. Оптическое возбуждение
- •1.3.2. Комбинационное рассеивание
- •1.3.3. Электрические способы возбуждения
- •1.4. Деление спектроскопии по свойствам излучения
- •1.4.1. Предмет и задачи спектроскопии
- •1.4.2. Деление спектроскопии по свойствам электромагнитного излучения
- •1.5. Деление спектроскопии по свойствам атомных систем
- •1.6. Типы уровней атомов и молекул
- •Тема 2: Спектроскопические методы анализа
- •2.1. Классификация типов спектрального анализа.
- •2.2. Деление спектроскопии по методам: некоторые особенности проведения анализа
- •2.3. Деление спектрального анализа по решаемым задачам: некоторые особенности проведения
- •2.3.1. Элементный спектральный анализ
- •2.3.2. Изотопный спектральный анализ.
- •2.3.3. Молекулярный спектральный анализ
- •Абсорбционный анализ по спектрам поглощения
- •Эмиссионный молекулярный спектральный анализ
- •2.3.4. Анализ структурных элементов сложных молекулярных соединений
- •1. Структурный анализ в уф и видимой областях
- •2. Спектральный структурный анализ в ик области
- •3. Структурный анализ по спектрам комбинационного рассеивания
- •2.4. Общие схемы проведения спектрального анализа
- •2 .4.1. Эмиссионный спектральный анализ
- •2.4.2. Абсорбционный спектральный анализ
- •2.5. Основные характеристики и области применения спектрального анализа
- •Часть 2: Атомная спектроскопия. Тема 3. Уровни энергии и спектры атома водорода и водородоподобных ионов.
- •3.1. Квантовые числа одноэлектронного атома и степень вырождения его уровней.
- •3.2. Невырожденные и вырожденные уровни энергии. Вырождение уровней одноэлектронного атома.
- •3.3. Правила отбора для одноэлектронных атомов.
- •3.4. Тонкая структура уровней энергии и спектральных линий.
- •3.5. Зависимость спектров одноэлектронных атомов от заряда и массы ядра.
- •3.6. Характеристика стационарных состояний одноэлектронного атома.
- •Тема 4. Электронные оболочки атомов и периодическая система элементов.
- •4.1. Квантовые числа электронов в сложном атоме и принцип Паули.
- •4.2. Электронные слои и оболочки и их заполнение.
- •4.3. Зависимость энергии электронов от орбитального кв. Числа.
- •4.4. Свойства элементов с заполненными и незаполненными оболочками.
- •4.5. Типы спектров различных элементов.
- •Тема 5: Основы общей систематики сложных спектров.
- •5.1. Сложение орбитальных и спиновых моментов и типы связи.
- •5.2. Общая характеристика нормальной связи.
- •Тема 6: Рентгеновские спектры.
- •6.1 Общая характеристика рентгеновских спектров поглощения и испускания.
- •6.2. Внутренняя конверсия рентгеновского излучения.
- •Тема 7: Явление Зеемана и магнитный резонанс.
- •7.1. Расщепление уровней энергии в магнитном поле.
- •7.2. Общая картина зеемановского расщепления спектральных линий.
- •Тема 8. Явление Штарка.
- •8.1. Общая характеристика явления Штарка.
- •8.2. Явление Штарка для атомов в общем случае.
- •Часть 4. Молекулярный спектральный анализ Тема 9: ик-спектрометрия и уф-спектрофотометрия
- •9.1. Строение молекулы
- •9.2. Молекулярные спектры
- •9.3. Вращательные спектры
- •9.4 Колебательные спектры
- •9.5 Электронные спектры
- •9.6 Аппаратура ик-спектроскопии.
- •2) Кюветное отделение.
- •3) Фотометр
- •4) Монохроматор
- •9.7 Аппаратура уф – спектроскопии
- •4)Кюветное отделение
- •Тема 10. Качественный и количественный молекулярный анализ.
- •D зависит только от числа поглощающих частиц на пути светового пучка и от их свойств.
- •5.1. Качественный молекулярный анализ
- •5.2. Количественный молекулярный анализ
- •3 Эмиссионный спектральный анализ.
Рекомендуемая литература:
Ельяшевич – Основы спектроскопии
Спектроскопические методы анализа – Коллектив авторов
Учебники по аналитической и физической химии
Часть 1. Тема 1: Основные положения спектроскопии
1.1. Основные квантовые законы (постулаты Бора)
Всё учение о спектрах электромагнитного излучения базируется на квантовой теории. Квантовые представления были впервые введены в спектроскопию Нильсом Бором, объяснившим в 1913 году спектр простейшего атома – водорода. Им были сформулированы 2 постулата, которые рассматривают как основные квантовые законы, которым подчиняются любые атомные системы.
Первый постулат Бора: атомная система является устойчивой лишь в определённых, стационарных состояниях, соответствующих некоторой дискретной/непрерывной последовательности значений энергии E системы. Любое изменение этой энергии связано со скачкообразным переходом системы из одного стационарного состояния в другое.
В соответствии с законом сохранения энергии, такие переходы связаны с получением или отдачей энергии системой. Ими могут быть:
Переходы с излучением (оптические переходы), когда атомная система испускает или поглощает электромагнитное излучение.
Переходы без излучения (не оптические), когда происходит непосредственный обмен энергии между рассматриваемой атомной системой и окружающими системами, с которыми она взаимодействует, например, возбуждение атомов и молекул электронным ударом, передача энергии внутреннего движения при столкновении между молекулами от одной молекулы к другой.
Второй постулат Бора (основной): ЭМИ, связанное с переходом атомной системы из стационарного состояния с энергией El в стационарное состояние с энергией Ek является монохроматическим и его частота v определяется соотношением:

![]() (1.1)
– основной
(второй) постулат Бора,
где h
– постоянная Планка. Если система
переходит с верхнего на нижний
энергетический уровень, то ЭМИ испускается,
а наоборот – поглощается.
(1.1)
– основной
(второй) постулат Бора,
где h
– постоянная Планка. Если система
переходит с верхнего на нижний
энергетический уровень, то ЭМИ испускается,
а наоборот – поглощается.
Поглощение и испускание происходит определёнными порциями hv, называемыми квантами излучения.
1.2. Уровни энергии и переходы между ними.
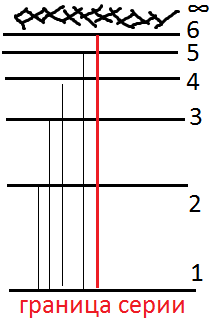
Рассмотрим простую схему уровней энергии, образующих дискретную последовательность.
К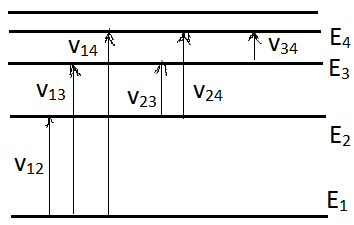 аждому
возможному переходу между уровнями
энергии соответствует определённая
спектральная
линия,
характеризующаяся частотой
монохроматического излучения. Из (1.1)
следует, что между частотами различных
спектральных линий должно выполняться
соотношение вида:
аждому
возможному переходу между уровнями
энергии соответствует определённая
спектральная
линия,
характеризующаяся частотой
монохроматического излучения. Из (1.1)
следует, что между частотами различных
спектральных линий должно выполняться
соотношение вида:
![]() (1.2)
– комбинационный
принцип Ридца.
(1.2)
– комбинационный
принцип Ридца.
Например,
из рисунка следует, что ![]()
Комбинационный принцип Ридца был установлен в 1908 году на основе обобщения опытных результатов.
Νβ: Комбинационный принцип играет важную роль в спектрометрии. Его соблюдение является критерием правильности схемы уровней, найденной из опытных значений частот спектральных линий.
С помощью (1.2) может быть найдены для спектральных линий, частоты которых известны с недостаточной точностью, более точные значения по частотам двух и более других линий.
Типы спектров:
Переходы между дискретными уровнями дают дискретный спектр, состоящий из отдельных линий.
Переходы между дискретным и непрерывным уровнями дают сплошной спектр.
Переходы между непрерывными уровнями дают сплошной спектр.
Основной
закон (1.1)
справедлив как для дискретных уровней
энергии, так и в случае, когда уровни
энергии образуют непрерывную
последовательность.