- •Физика ответы
- •Вопрос 1. Физика – одна из наук, изучающих природу. Свое название физика получила от греческого слова «фюзис», что в переводе означает «природа».
- •Вопрос 4. Кинематика занимается описанием механического движения и отвечает на вопрос: «Как движется тело?».
- •Вопрос 5. Прямолинейное движение — механическое движение, при котором вектор перемещения (∆r) не меняется по направлению и по величине равен длине пути, пройденного телом.
- •Вопрос 6. Если траектория точки является кривой линией, то такое движение называется криволинейным.
- •Вопрос 8. Система отсчёта — это совокупность тела отсчета, системы координат и системы отсчёта времени, по отношению к которым рассматривается движение каких-либо материальных точек или тел.
- •Вопрос 9. Основная задача динамики: определить закон движения материальной точки, если известно, как данная материальная точка взаимодействует с окружающими её телами.
- •Вопрос 11. Законы Ньютона впервые были сформулированы в 1686 году.
- •Вопрос 18. В 1920 г. О.Штерн поставил опыт по определению скорости молекул газа или пара.
- •Вопрос 19.
- •Вопрос 21. Тела и вещества состоят из отдельных частиц, между которыми есть промежутки.
- •Вопрос 22. Основные предположения:
- •Вопрос 23. Основные физические характеристики молекул:
- •Вопрос 31. Газы обладают рядом свойств, которые делают их незаменимыми в очень большом числе технических устройств.
- •Вопрос 32. Внутренняя энергия тела— это сумма энергий молекулярных взаимодействий и тепловых движений молекулы.
- •Вопрос 33. Тепловое равновесие– это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными.
- •Вопрос 34.
- •Вопрос 35. Процесс изменения внутренней энергии без совершения работы над телом или самим телом называется теплопередачей.
- •Вопрос 36. Количество теплоты(q)- энергия, переносимая от одной системы к другой только за счёт разницы в температурах этих систем.
- •Вопрос 37. Первый закон термодинамики- обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
- •Вопрос 38.
- •Вопрос 39. Адиабатический, или адиабатный процесс — термодинамический процесс, при котором система не обменивается тепловой энергией с окружающим пространством.
- •Вопрос 41. Диффузия в природе является односторонним, а тем самым и необратимым процессом. Смесь газов, сколько бы мы не ждали, не разделится на исходные компоненты.
- •Вопрос 44. Тепловой двигатель- устройство, в котором происходит преобразование внутренней энергии топлива в механическую.
- •Вопрос 45. Холодильная машина — устройство, служащее для отвода теплоты от охлаждаемого тела при температуре более низкой, чем температура окружающей среды.
- •Вопрос 46. Факты негативного влияния тепловых двигателей на окружающую среду:
- •Вопрос 47. Не знаю пока что как делать.
- •Вопрос 52. Некоторые твёрдые тела встречаются в природе в виде кристаллов- тел, грани которых представляют собой правильные многоугольники.
- •Вопрос 53. В узлах кристаллической решётки могут располагаться либо атомы, либо молекулы, либо ионы. В зависимости от структуры кристаллической решётки все вещества можно разбить на четыре группы.
- •Вопрос 57. Деформация - изменение объема или формы тела.
- •Вопрос 60. Смачивание — это явление, заключающееся во взаимодействии жидкости с поверхностью твёрдого тела или другой жидкости.
- •Вопрос 61. Тепловым расширением называется увеличение линейных размеров и объемов тел, происходящее при повышении их температуры.
- •Вопрос 64. Наглядной силовой характеристикой электрического поля являются линии напряженности (силовые линии электрического поля).
- •Вопрос 65. Электрический ток называют постоянным, если сила тока и его направление не меняются с течением времени.
- •Вопрос 67. Электрическое сопротивление ( ) - свойство проводника создавать помехи прохождению электрического тока.
- •Вопрос 72.
- •Вопрос 73. Работа тока - это работа электрического поля по переносу электрических зарядов вдоль проводника;
- •Вопрос 74. Ток, протекая по проводнику, вызывает его нагревание. Это явление называется тепловым действием тока.
- •Вопрос 75. Лабораторная работа последняя была это.
- •Вопрос 76.
Вопрос 22. Основные предположения:
Число молекул в газе велико: N >> 1, среднее расстояние между отдельными молекулами много больше их размеров (l >> a).
Молекулы газа совершают неупорядоченное, хаотическое движение.
Движение отдельных молекул подчиняется законам классической механики.
Все соударения молекул друг с другом и со стенками сосуда, в котором находится газ, являются абсолютно упругими (происходят без потери энергии).
Основное уравнение молекулярно-кинетической теории идеального газа утверждает: Произведение давления идеального газа на его объем пропорционально плотности числа молекул в газе и средней кинетической энергии поступательного движения отдельной молекулы, т.е.
![]() .
.
Вопрос 23. Основные физические характеристики молекул:
Размер молекулы.

Масса молекулы.

Число молекул.

Скорость молекул.

Вопрос 24. Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию. Абсолютный ноль определён как 0 K, что равно −273.15 °C. Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Температура, при которой частицы вещества имеют минимальное количество движения, сохраняющееся только благодаря квантовомеханическому движению, — это температура абсолютного нуля (Т = 0К).
Вопрос 25. Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
![]() где р - давление, m0-
масса молекулы, п - концентрация (число
молекул в единице объема), v2- средний
квадрат скорости молекул.
где р - давление, m0-
масса молекулы, п - концентрация (число
молекул в единице объема), v2- средний
квадрат скорости молекул.
Вопрос 26.

Вопрос 27.

Вопрос 28. Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
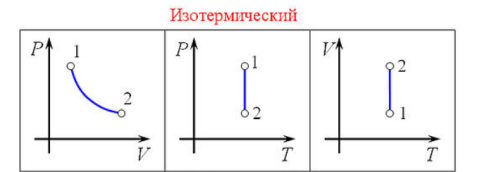
Изотермический
процесс — процесс
изменения состояния термодинамической
системы при постоянной температуре
( ),(
),( ).
).
Изотермический процесс описывается законом Бойля — Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
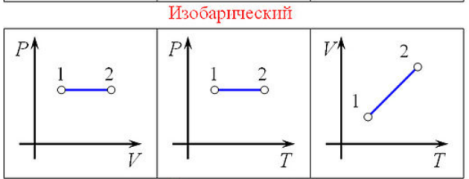
Вопрос 29. Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
Изобарный
процесс — процесс
изменения состояния термодинамической
системы при постоянном давлении ( ).
).
Зависимость
объёма газа от температуры при неизменном
давлении была экспериментально
исследована в 1802 году Жозефом Луи
Гей-Люссаком. Закон
Гей-Люссака: При
постоянном давлении и неизменных
значениях массы газа и его молярной
массы, отношение объёма газа к его
абсолютной температуре остаётся
постоянным:

Вопрос 30. Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
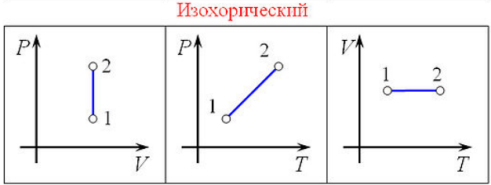
Изохорный
процесс— процесс
изменения состояния термодинамической
системы при постоянном объёме ( ).
).
Для
идеальных газов изохорический процесс
описывается законом
Шарля: для
данной массы газа при постоянном объёме,
давление прямо пропорционально
температуре: