
- •Вопросы для самостоятельного изучения
- •Часть 4
- •1. Разделение неограниченно смешивающихся жидкостей методом перегонки.
- •Разделение азеотропных смесей
- •2. Диаграмы плавкости
- •Системы с образованием химических соединений, плавящихся конгруэнтно ( с образованием устойчивых химических соединений)
- •2.2 Системы с образованием химических соединений, плавящихся инконгруэнтно (системы с образованием неустойчивых химических соединений)
- •2.3 Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной растворимостью в твердом состоянии
- •2.4 Системы с неограниченной растворимостью компонентов и в жидкой и в твердой фазе
- •3. Трёхкомпонентные системы
- •3.1 Графическое изображение состава трехкомпонентных систем
- •3.2 Равновесие жидкость – жидкость в трехкомпонентных системах
- •4. Распределение растворяемого вещества между двумя несмешивающимися жидкостями
- •Отклонения от закона распределения
- •Экстракция
3.2 Равновесие жидкость – жидкость в трехкомпонентных системах
Возможны следующие состояния.
Жидкости неограниченно растворимы друг в друге. Система гомогенна при любых концентрациях, фаза одна, С=3 – 1=2; концентрации любых двух компонентов можно изменить произвольно, система останется однофазной.
Жидкости совершенно не растворимы друг в друге. Система расслаивается на три жидких слоя, три фазы, С=3 – 3=0; ни одну из концентраций нельзя изменять, т. к. фазы состоят из чистых компонентов.
Жидкости ограниченно растворимы друг в друге. Пусть компоненты А и С, а также В и С попарно неограниченно растворимы друг в друге, компоненты А и В ограниченно растворимы друг в друге. Тогда при постоянном давлении трехмерная диаграмма состояния имеет следующий вид.
О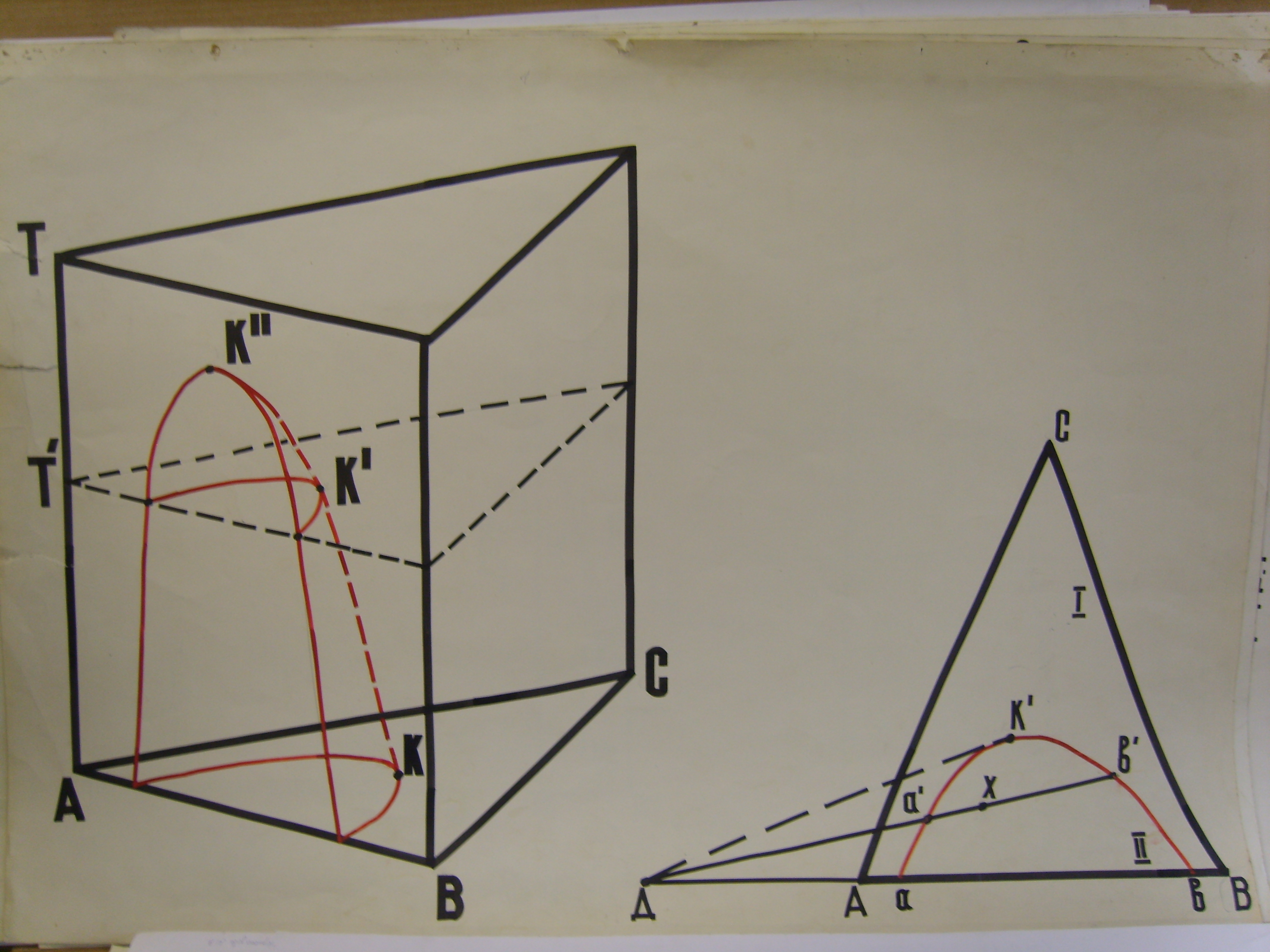 бласть
под куполообразной поверхностью –
область расслоения; система гетерогенна.
Внешняя область соответствует гомогенной
системе. Рассмотрим сечение трехмерной
диаграммы плоскостью
бласть
под куполообразной поверхностью –
область расслоения; система гетерогенна.
Внешняя область соответствует гомогенной
системе. Рассмотрим сечение трехмерной
диаграммы плоскостью
![]() .
.
В треугольнике АВС область I– гомогенная, область II – гетерогенная.
Линия
![]() - кривая расслоения или бинодальная
кривая, система расслаивается на два
жидких слоя. Чтобы определить составы
слоев (например, для системы, общий
состав которой изображается точкой Х),
нужно через эту точку провести ноду до
пересечения с кривой расслоения. Точки
- кривая расслоения или бинодальная
кривая, система расслаивается на два
жидких слоя. Чтобы определить составы
слоев (например, для системы, общий
состав которой изображается точкой Х),
нужно через эту точку провести ноду до
пересечения с кривой расслоения. Точки
![]() и
и
![]() соответствуют составам равновесных
фаз. Согласно правилу Тарасенкова все
ноды сходятся в одной точке, лежащей на
продолжении стороны треугольника. Это
правило приближенное. Относительное
количество фаз определяют по правилу
рычага.
соответствуют составам равновесных
фаз. Согласно правилу Тарасенкова все
ноды сходятся в одной точке, лежащей на
продолжении стороны треугольника. Это
правило приближенное. Относительное
количество фаз определяют по правилу
рычага.
При добавлении третьего компонента С к системе, состоящей из двух компонентов А и В, взаимная растворимость жидкостей возрастает.
Другие виды диаграмм растворимости трехкомпонентных систем:

4. Распределение растворяемого вещества между двумя несмешивающимися жидкостями
Рассмотрм систему, состоящуб из двух несмешивающихся жидкостей I и II. Поместим в каждую жидкость небольшое количество третьего компонента, растворимого как в первой, так и во второй жидкости.
О бозначим
бозначим
![]() - концентрация третьего компонента в I
фазе.
- концентрация третьего компонента в I
фазе.
![]() - концентрация третьего компонента во
II
фазе. Закон распределения:
- концентрация третьего компонента во
II
фазе. Закон распределения:
Отношение концентраций третьего компонента в двух равновесных жидких фазах является величиной постоянной при данной температуре :
 .
.
К
- коэффициент распределения, зависит
от Т и природы веществ, и не зависит от
концентрации. Для концентрированных
растворов концентрацию нужно заменить
активностью:
 ,
здесь К – термодинамическая константа
распределения.
,
здесь К – термодинамическая константа
распределения.
Отклонения от закона распределения
Если величина частиц растворенного компонента не одинакова в разных фазах, то наблюдаются отклонения от закона распределения. В общем виде закон распределения имеет следующий вид:
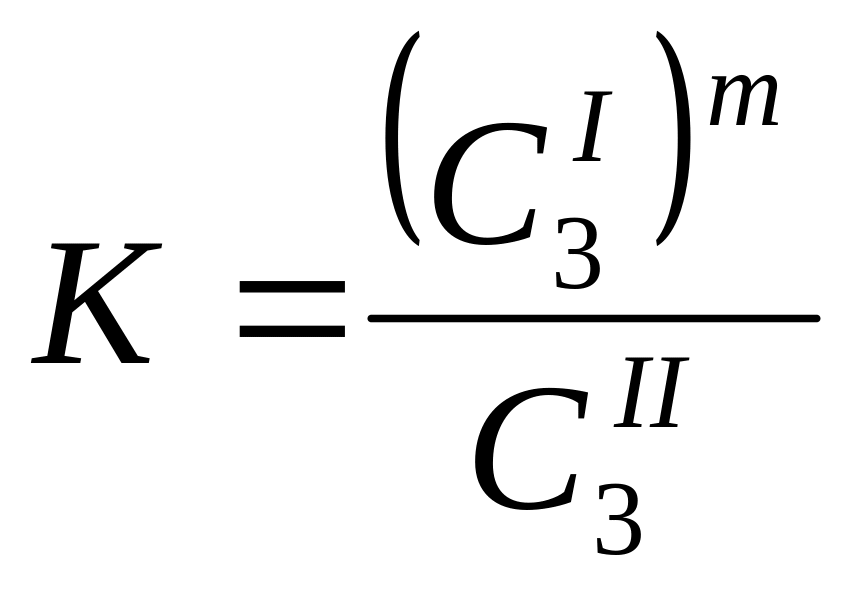 .
.
m
– постоянная величина для данной системы
при постоянной температуре, может
зависеть от концентрации. Например,
если все молекулы растворенного вещества
в I
фазе диссоциируют:
![]() ,
а в другой не диссоциируют, то m=2.
Если все молекулы растворенного вещества
в I
фазе ассоциированы в димеры:
,
а в другой не диссоциируют, то m=2.
Если все молекулы растворенного вещества
в I
фазе ассоциированы в димеры:
![]() ,
то m=½
. Eсли
диссоциация или ассоциация не полная,
то m
зависит от степени диссоциации.
,
то m=½
. Eсли
диссоциация или ассоциация не полная,
то m
зависит от степени диссоциации.
