
- •«Мордовский государственный университет им. Н. П. Огарёва»
- •Курсовая работа флуоресцентный анализ нейронов пиявки
- •«Мордовский государственный университет им. Н. П. Огарёва»
- •Задание на курсовую работу
- •Реферат
- •Обозначения и сокращения
- •Содержание
- •Введение
- •Обзор литературы
- •Основные характеристики флуоресценции
- •1.1.1 Метод флуоресцентных зондов
- •Флуоресцентные зонды, используемые в биологии и медицине
- •Флуоресцеин
- •Хлортетрациклин
- •Родамин с
- •1.2 Общая характеристика медицинской пиявки
- •1.2.1 Нервная система медицинской пиявки
- •1.2.1.1 Сенсорные клетки
- •1.2.1.2. Моторные клетки
- •Материал и методы исследования
- •Материал исследования
- •Методы исследования
- •Приготовление препаратов. Растворы и реактивы
- •2.2.2 Приготовление раствора хтц и ф
- •2.2.3 Флуоресцентная спектроскопия
- •2.2.4 Метод оптического имиджинга на основе системы визуализации ivis® LuminaIi
- •Метод оптической микроскопии
- •Список использованных источников
2.2.4 Метод оптического имиджинга на основе системы визуализации ivis® LuminaIi
Данный метод использовался для определения интенсивности флуоресценции нервных ганглиев, вызванной флуоресцеином. IVIS® Lumina II (далее Lumina) является высокочувствительной in vivo визуализационной технологической платформой с низким уровнем шума, которая позволяет проводить неинвазивную визуализацию и отслеживание клеточной и генетической активности в режиме реального времени.
IVIS Lumina позволяет получить изображения даже при очень низком уровне освещенности, которые затем могут быть сохранены и отображены для последующего анализа.
Данный метод исследования предназначен для неинвазивной прижизненной (in vivo) визуализации живых объектов малых размеров с целью изучения их клеточной и тканевой активности в режиме реального времени.
IVIS Lumina позволяет визуализировать флуоресцентные возможности для in vitro и in vivo приложений. Диапазон чувствительности системы позволяет использовать для флуоресценции длины волн от 400 до 950 нм.
Флуоресцентное изображение образцов с эпископическим разрешением (эпископическое освещение производилось при помощи источника освещения возбуждения, расположенного над платформой) получали при помощи оборудования для флуоресценции XFO–12 (рисунок 7 ) в программе Living Image следующим образом: запускали программу Living Image затем выполняли инициализацию системы визуализации IVIS и дожидались, пока установится температура ПЗС–камеры. Во вкладке Exposure Time (время экспозиции) ставили 60 секунд. Выбирали фильтр Cyt5.5 с возбуждением 495нм и излучением 521нм.

Рисунок 7 – Панель управления получением изображения
Указывали высоту объекта 1,5 см. в выпадающем списке Lamp Level выбирали пункт off. После чего выбирали Acquire (Получить). Затем полученные данные сохраняли в расширении программы Living Image и в формате JPEG–рисунка.
На полученном рисунке в программе Living Image возможно высчитать количество квантов света излучаемых объектом. Зная площадь объекта (также высчитанную в программе Living Image) определяем количество квантов света излучаемых единицей площади объекта (квант/см2) деля количество квантов на площадь объекта.
Метод оптической микроскопии
В дополнение к вышеуказанным методам, нами так же был использован метод оптической микроскопии.
Оптическая микроскопия занимает важное место в ряду методов исследования макромолекул и надмолекулярной структуры объектов, она позволяет непосредственно наблюдать объект или его участок и существенно (с 0,2 мм до 0,2 мкм) расширять пределы визуального наблюдения. Оптическая микроскопия представляет собой удобный и гибкий метод прямого изучения микроструктуры. Поэтому трудно представить: какой метод может ее вытеснить при изучении структуры клеток и органоидов клеток, в особенности при сочетании оптической микроскопии с косвенными методами исследования.
Метод оптической микроскопии обычно не требует специального препарирования исследуемых объектов. Наиболее удобны для изучения в проходящем свете образцы в виде тонких пленок или срезов с массивных блоков, толщина которых может колебаться от нескольких – до сотен микрон [28].
Результаты и их обсуждение
Для флуоресцентного анализа нами были взяты 2 зонда – Ф и ХТЦ. Определяли в водных растворах спектр излучения длин волн флуоресцентного излучения для каждого из них на спектрофлуориметре , как видно из рисунка 8, Ф соответствует 518нм, из рисунка 9 ХТЦ–530нм. Это соответствует литературным данным [13].
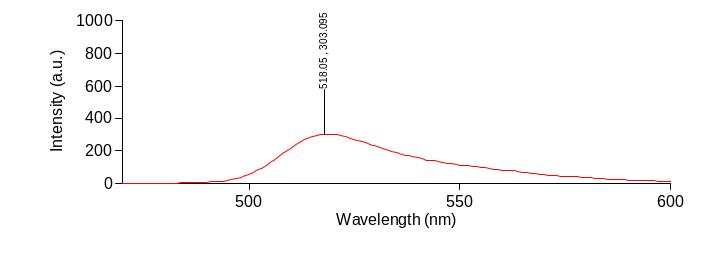
Рисунок 8 – Спектр излучения флуоресцеина на спектрофлуориметре
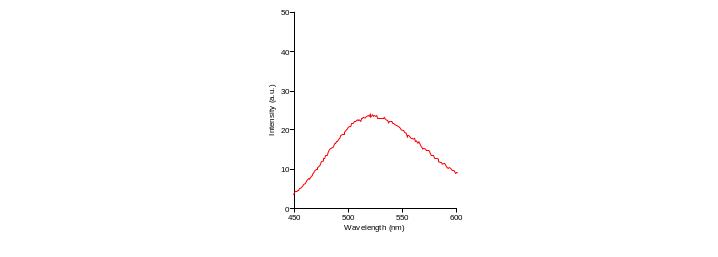
Рисунок 9 – Спектр излучения хлортетрациклина на спектрофлуориметре
Окрашивание пиявки производилось в растворе флуоресцеина в течение 4 часов, предварительно усыпив в растворе белого вина (10 % раствор этанола). Наблюдалось только свечение слизи покрывающей пиявку (рисунок 10).
Наружные покровы медицинской пиявки носят название кожицы. Тончайшая кожица состоит из одного слоя печатковидных клеток, формирующих особую ткань под названием эпидермис. Снаружи эпидермальный слой покрыт особой пленкой – хитиноподобной кутикулой. Химический состав кутикулы: липоиды, протеины, хитин, азотистое органическое эластичное вещество, стойкое химически. Кутикула прозрачна, она выполняет защитную функцию и непрерывно растет, периодически обновляясь в процессе линьки. В норме линька происходит у пиявок каждые 2–3 дня. Сброшенные пленки напоминают белые хлопья или небольшие белые чехлы. Кожица содержит большое количество нервных клеток и слизистых желез. Железы выделяют вещество, образующее гелевую массу, которая покрывает кутикулу пиявок. На теле здоровой пиявки всегда присутствует небольшое количество слизи, из–за чего поверхность тела обычно бывает скользкой и влажной. У разных особей количество слизи на теле различно []. Это и может быть причиной не проникновения данного зонда внутрь тела пиявки, так как эта гелевая масса образует своеобразный чехол на теле, который не пропускает зонд. Либо, возможно, что хитиноподобные кожные покровы пиявки не пропускают данный флуоресцентный зонд.
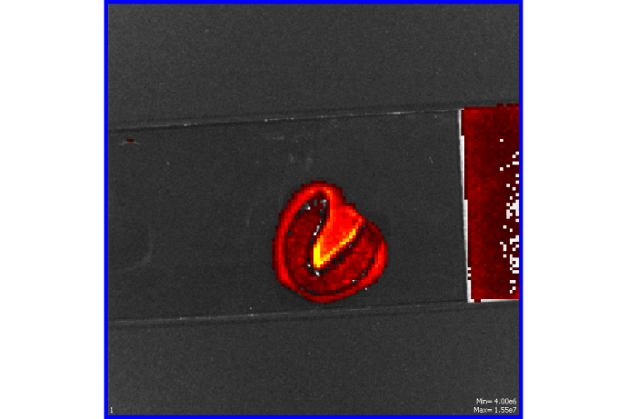
Рисунок 10 – Флуоресцентное свечение слизи пиявки
После того как слизь была удалена свечение прекращалось (рисунок 10, 11).
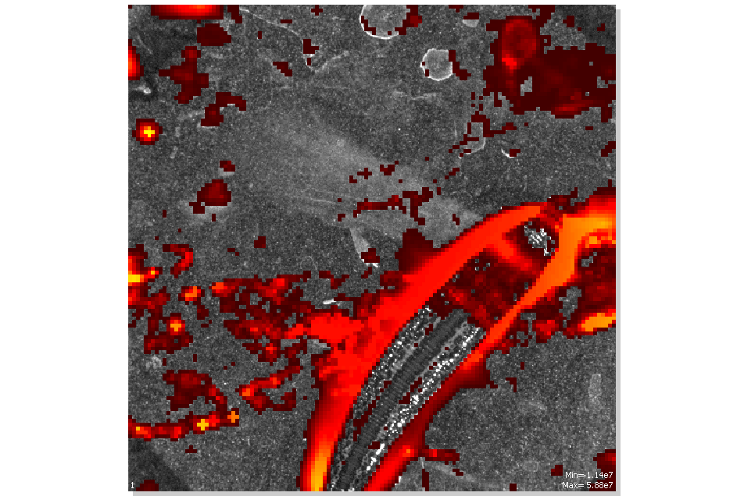
Рисунок 11 – Сравнение флуоресцентного свечения пиявки без слизи
При введении Ф внутрь пиявки с помощью инъекции (объем = 0,2мл), флуоресценция так же отсутствовала. Как мы предполагаем это можно объяснить либо тем, что мы не попали в кровеносные сосуды и зонд не распространился по организму пиявки, либо кожные покровы препятствуют регистрации флуоресценции пиявки прибором (рисунок 12).

Рисунок 12 – Флуоресцентное изображение пиявки после введения зонда внутрь с помощью инъекции
После окрашивания выделенной цепочки ганглиев 1мМ раствором Ф в течение 15 мин по всей длине цепочки наблюдалась интенсивная флуоресценция (рисунок 13)
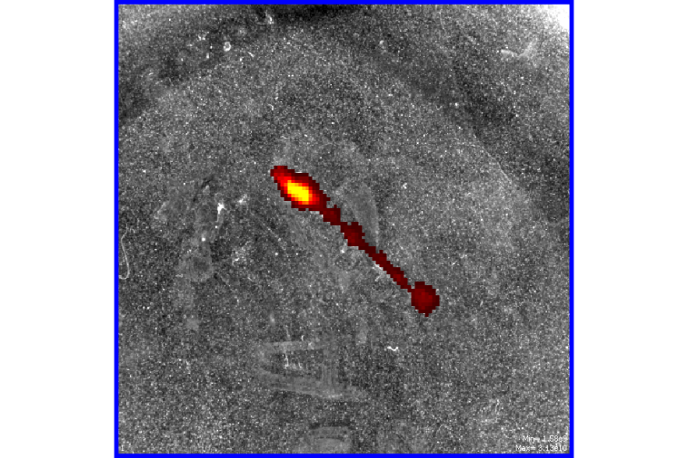
Рисунок 13 – Флуоресцентное свечение цепочки ганглиев пиявки
Таблица 4 – Количественное представление данных полученных методом оптического имиджинга на основе системы визуализации IVIS® LuminaII
Полный поток [p/s] |
В среднем фотоны [p/s/cm2/sr] |
Минимальная флуоресценция |
Максимальная флуоресценция |
Площадь [cm2] |
1.215*10+11 |
96810+10 |
4.251*10+09 |
8.715*10+10 |
0,4913 |
Для определения количества квантов света излучаемых единицей площади объекта (квант/см2) делим количество квантов на площадь объекта.
Так же нами были получены изображения нервных ганглиев и коннектив с помощью оптического микроскопа «Cetix» Увеличение в 250 и 400 раз (рисунок 14,15)
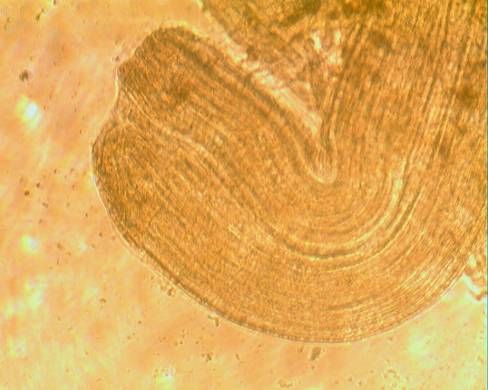
Рисунок 14 – Коннектива соединяющая сегментальные ганглии медицинской пиявки.
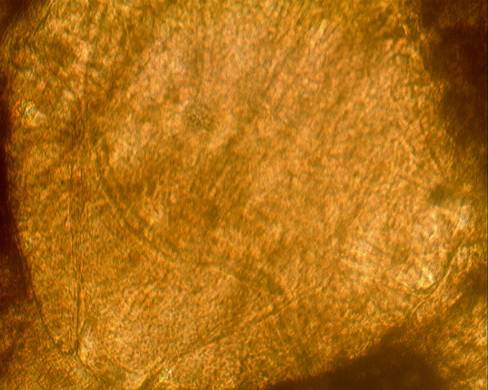
Рисунок 15 – Сегментальный ганглий медицинской пиявки
Вначале мы получили спектры флуоресценции растворов красителей ХТЦ и Ф (рисунок 16, 17 ) Концентрация зондов составляет 1мМ, зонды были растворены в дистиллированной воде.
.
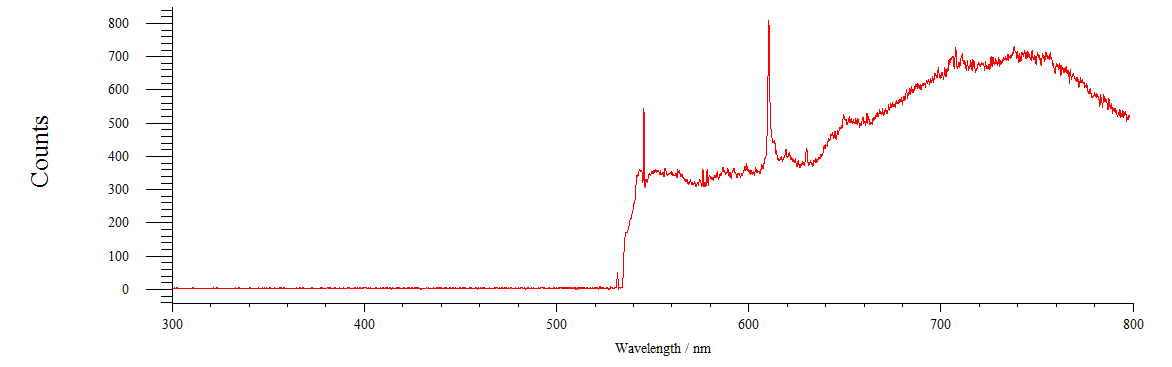
Рисунок 16 – Спектр флуоресценции раствора хлортетрациклина
На рисунке 16 видно, что максимум флуоресценции ХТЦ находится в области 740 нм
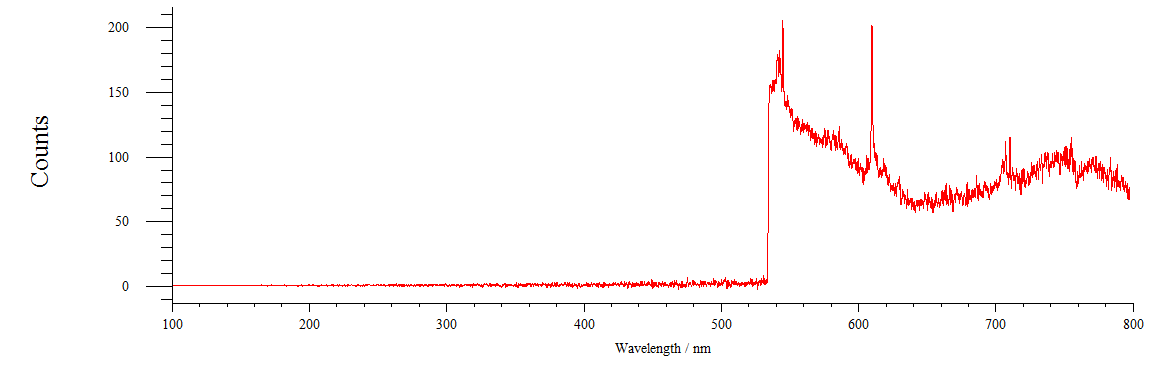
Рисунок 17 – Спектр флуоресценции раствора флуоресцеина
Максимум флуоресценции Ф находится в области 760 нм (рисунок 17)
Так же была зарегистрирована флуоресценция нервной цепочки (рисунок 18). На нём видно что нервная цепочка имеет 3 пика флуоресценции, в области 620нм,690нм и 760 нм.
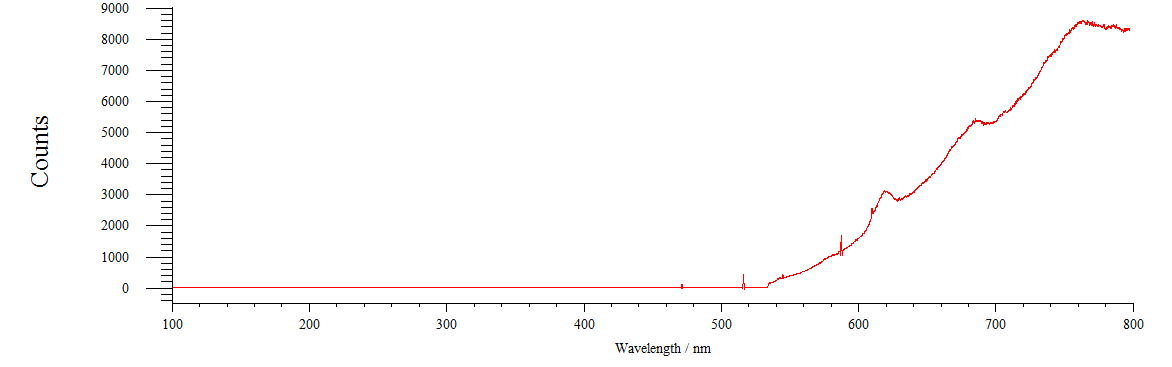
Рисунок 18 – Спектр флуоресценции нервной цепочки
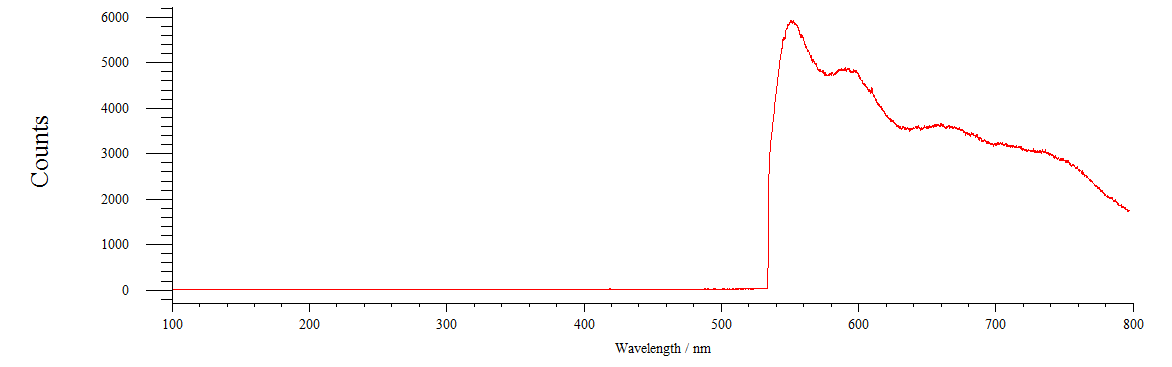
Рисунок 19 – Спектр флуоресценции нервной цепочки, проинкубированной в растворе хлортетрациклина
На рисунке 19 мы наблюдаем, что после инкубирования нервной цепочки в ХТЦ, спектр флуоресценции изменяется. Максимум флуоресценции приходиться на 600 и 660 нм. Это может говорить о том, что зонд ХТЦ, попадая в цепочку, меняет состояние цепочки и компонентов её составляющих.
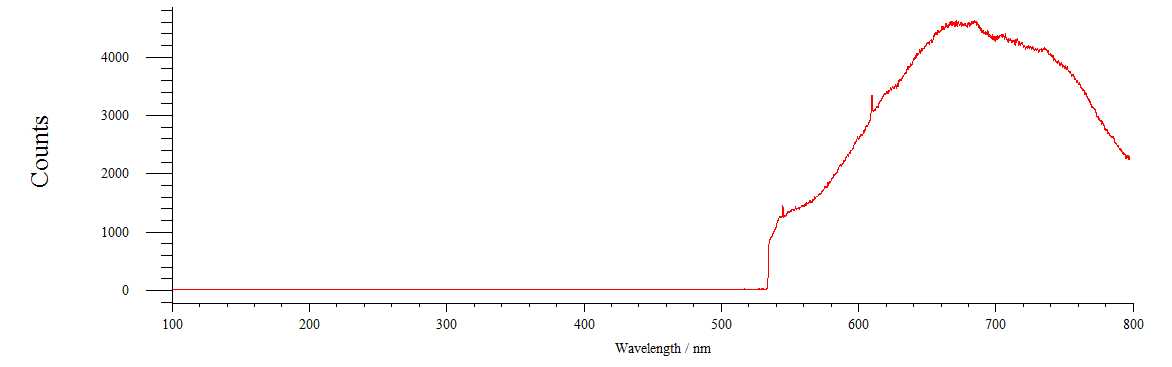
Рисунок 20 – Спектр флуоресценции нервной цепочки, проинкубированной в растворе флуоресцеина
Спектр флуоресценции нервной цепочки, проинкубированной в растворе Ф,как мы видим на рисунке 20, тоже изменился. Максимум флуоресценции составлет 670 нм. Это изменение спектра флуоресценции так же нам говорит, о том, что зонд, встраиваясь в цепочку, либо сам изменяет свою конформацию, либо изменяет конформацию молекул, её составляющих, что влечет за собой и изменение максимума флуоресценции.
Выводы
Были изучены спектры возбуждения и излучения для флуоресцеина – 495нм и 521нм и хлортетрациклина – 405нм и 530нм соответственно. Это соответствует литературным данным [13].
Нами была разработана методика регистрации флуоресценции на целом животном. Подобраны оптимальные условия для её проведения: концентрация зонда в растворе 1мМ, время инкубирования-4 часа, зонд растворяли в дистиллированной воде и хранили в темном месте во избежание его выцветания.
Для введения в целое животное флуоресцентного зонда, животное предварительно усыпляли, далее нами проводилась инъекция с брюшной стороны пиявки инсулиновой иглой водного раствора зонда с концентрацией 1мМ. Объем введенного раствора составляет 0,1-0,5 мл в зависимости от размера животного. Для наилучшего распространения зонда следует подождать 30мин, только после этого проводить измерение флуоресценции.
Для приготовления препарата цепочки нервных ганглиев медицинской пиявки животное анестезировали с помощью 10%–го раствора этанола. Для выделения ганглиев пиявку вскрывали с брюшной стороны и очищали выбранный ганглий от сосудистой оболочки. Все операции проводились в растворе Рингера для беспозвоночных (NaCl 115 мМ, KCl 4 мМ, CaCl2 1,8 мМ, MgCl2 1 мМ, рН 7,4; 200C). Работу проводили при комнатной температуре (200С). Отпрепарированную цепочку ганглиев фиксировали на предметном стекле вентральной стороной вверх и накрывали покровным стеклом – для оптической микроскопии. Для проведения флуоресцентной микроскопии помещали в водный раствор Ф, инкубировали её там 15мин затем отмывали в растворе Рингера и определяли уровень флуоресценции на системе визуализации IVIS® LuminaII и получали спектры флуоресценции на микроскопе inVia компании Renishaw.
