
- •Влажность воздуха.
- •Точка росы.
- •Приборы их определения.
- •Кипение. Критическое состояние вещества.
- •Режимы кипения:
- •Критическое состояние вещества:
- •Сжижение газов. Характеристика жидкого состояния вещества.
- •[Править]Физические основы сжижения газов
- •[Править]Применение сжиженных газов
- •Характеристика жидкого состояния вещества.
- •Поверхностное натяжение. Смачивание.
- •Смачивание.
- •Капиллярные явления в природе, быту и технике.
- •Кристаллическое состояние вещества.
- •Механическое свойства твердых тел. Закон Гука. Тепловое расширение твердых тел и жидкостей.
- •Закон Гука.
- •Тепловое расширение твердых тел и жидкостей.
- •Плавление и кристаллизация.
- •Сублимация и Десублимация
- •Десублимация
- •Диаграмма равновесных состояний и фазовых переходов. Тройная точка.
- •Явление электризации тел.
Сублимация и Десублимация
Сублимация (возгонка, от лат. sublimoвозношу), переход вещества из твердого состояния непосредственно (без плавления) в газообразное. Ссублимация подчиняется общим законам испарения. Обратный процесс - конденсация вещества из газообразного состояния, минуя жидкое, непосредственно в твердое состояние-называют десублимацией.
Десублимация
ДЕСУБЛИМАЦИЯ процесс, обратный сублимации.
Вопрос №24
Диаграмма равновесных состояний и фазовых переходов. Тройная точка.
Фаза — термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Если, например, в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза — вода; газообразная фаза — водяные пары. Если система является однокомпонентной, т. е. состоящей из химически однородного вещества, то понятие фазы совпадает с понятием агрегатного состояния вещества, которое может быть жидким, твердым или газообразным.
Агрегатное
состояние вещества зависит
от его давления ![]() и
температуры
и
температуры ![]() .
Кривые фазового равновесия на диаграмме
состояния показывают значения давления
и температуры, при которых возможно
равновесие двух фаз.
.
Кривые фазового равновесия на диаграмме
состояния показывают значения давления
и температуры, при которых возможно
равновесие двух фаз.
|
|
Фазовая диаграмма в общем виде |
Фазовая диаграмма воды |
Точка,
в которой пересекаются эти кривые,
определяет температуру ![]() и
давление
и
давление ![]() одновременного
равновесного сосуществования трех фаз
вещества. Эта точка называется тройной
точкой. Каждое вещество имеет только
одну тройную точку. Тройная точка воды
характеризуется температурой
одновременного
равновесного сосуществования трех фаз
вещества. Эта точка называется тройной
точкой. Каждое вещество имеет только
одну тройную точку. Тройная точка воды
характеризуется температурой ![]() (
(![]() )
и давлением
)
и давлением ![]() .
.
ФАЗОВЫЕ
ПЕРЕХОДЫ I РОДА
Плавление —
переход из твердого кристаллического
состояния в жидкое.
Кристаллизация (затвердевание)
— переход вещества из жидкого в
кристаллическое (твердое)
состояние.
Сублимация (возгонка)
— переход из твердого кристаллического
состояния в газообразное.
Конденсация —
переход из газообразного состояния в
жидкое или твердое.
Испарение —
переход из жидкого состояния в
газообразное.
Тепловой
эффект фазового
перехода I рода рассчитывается по
формуле: ![]() ,
где
,
где ![]() —
удельная теплота фазового перехода
—
удельная теплота фазового перехода ![]() —
количество тепла, поглощаемого или
выделяемого при фазовом переходе 1
килограмма вещества,
—
количество тепла, поглощаемого или
выделяемого при фазовом переходе 1
килограмма вещества, ![]() —
масса вещества.
—
масса вещества.
Уравнение
Клапейрона — Клаузиуса
Производная
от равновесного давления по температуре ![]() ,
где
,
где ![]() —
теплота, поглощаемая 1 молем вещества
при фазовом переходе 1 – 2,
—
теплота, поглощаемая 1 молем вещества
при фазовом переходе 1 – 2, ![]() —
изменение объема 1 моля вещества при
переходе его из первой фазы во вторую.
—
температура перехода (процесс
изотермический). Поскольку для большинства
веществ
—
изменение объема 1 моля вещества при
переходе его из первой фазы во вторую.
—
температура перехода (процесс
изотермический). Поскольку для большинства
веществ ![]() ,
то кривая фазового равновесия наклонения
вправо, так как
,
то кривая фазового равновесия наклонения
вправо, так как ![]() .
Есть исключения. Например, объем воды
меньше объема льда
.
Есть исключения. Например, объем воды
меньше объема льда ![]() .
Поэтому, кривая плавления воды наклонена
влево
.
Поэтому, кривая плавления воды наклонена
влево ![]() .Изотермы
перехода из жидкого состояния в
газообразное
.Изотермы
перехода из жидкого состояния в
газообразное
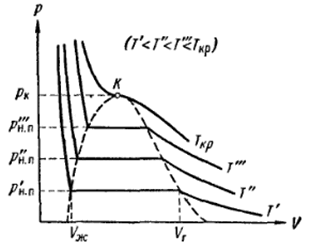 Кривая
испарения на диаграмме состояния
заканчивается в критической точке. Если
температура оказывается выше критической,
то различие между жидкой и газообразной
фазой пропадает, наблюдается явление
критической опалесценции.
Кривая
испарения на диаграмме состояния
заканчивается в критической точке. Если
температура оказывается выше критической,
то различие между жидкой и газообразной
фазой пропадает, наблюдается явление
критической опалесценции.
Тройная точка:
Тройна́я то́чка воды́ — строго определенные значения температуры и давления, при которых вода может одновременно и равновесно существовать в виде трёх фаз — в твердом, жидком игазообразном состояниях. Тройная точка воды — температура 273,16 К и давление 611,657 Па.Как видно из параметров тройной точки воды, при нормальных условиях равновесное сосуществование льда, водяного пара и жидкой воды невозможно. Это обстоятельство вроде бы противоречит обыденным наблюдениям — лёд, вода и пар часто наблюдаются одновременно. Но противоречия нет — наблюдаемые состояния далеки от термодинамически равновесных и реализуются на практике только из-за кинетических ограничений фазовых переходов. Тройная точка воды характеризуется определенным набором параметров давления и температуры, поэтому может иногда использоваться как «реперная» — то есть опорная, например, для калибровки приборов.
Вопрос №26


