
Лекция №1 (доп. Материал)
Стандартный электродный потенциал Е0 – это электродный потенциал, измеренный при стандартных условиях:
концентрация ионов металла равна 1 моль/л;
температура 25°С (298 К);
для газообразных веществ давление 101325 Па (1 атм.).
Абсолютное значение электродного потенциала измерить не возможно!!!
Поэтому электродные потенциалы измеряют относительно стандартного водородного электрода, выбранного в качестве электрода сравнения, потенциал которого в стандартных условиях принят равным нулю, хлоридсеребряный, каломельный и другие электроды, потенциалы которых измеряют по отношению к водородному электроду.
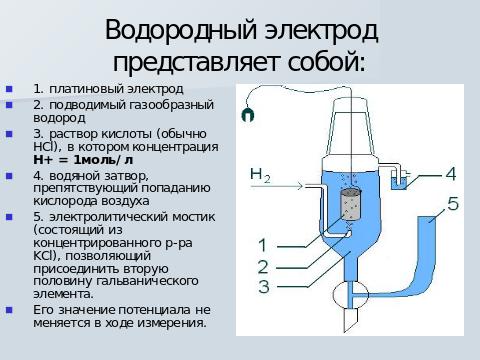

Выводы из ряда напряжения:
1. Ме –это элементы, которые за счет отдачи электронов являются восстановителями. Восстановительная способность Ме зависит от их активности. Чем меньше Е0, тем Ме являются более активными, поэтому все левее стоящие Ме в ряду напряжения способны вытеснять правее стоящие Ме из растворов их солей.
2. Ме стоящие в ряду активности левее (Н) способны восстановить (Н) из кислот (исключение: азотная и азотистая кислоты). Из HNO3 и HNO2 кислот происходит восстановление оксидов азота I или II.
НАПРИМЕР:
Ме (акт.)+ HNO3 (разб.)→ соль + оксид азота (I) + вода;
Ме (акт.)+ HNO3 (конц.)→ соль + оксид азота (II) + вода;
3. Ме стоящие в ряду активности правее (Н) не способны восстановить (Н) из кислот (исключение: азотная и азотистая кислоты). Из HNO3 и HNO2 кислот происходит восстановление оксидов азота II или IV.
НАПРИМЕР:
Ме (пас.)+ HNO3 (разб.)→ соль + оксид азота (II) + вода;
Ме (пас.)+ HNO3 (конц.)→ соль + оксид азота (IV) + вода;
Лекция № 2
1. При работе гальванического элемента,
состоящего из серебряного и медного электродов,
погруженных в 0,01 М растворы их нитратов
(Е°Ag+/ Ag0 = + 0,80 B; Е°Cu2+/ Cu0 = + 0,34 B)
на аноде протекает реакция, уравнение которой имеет вид
1) Ag0 − ē → Ag+ 2) Ag+ + ē → Ag0
3) Cu2+ + 2ē → Cu0 4) Cu0 − 2ē → Cu2+
2. Если гальванический элемент содержит стандартный никелевый электрод
(Е0 = − 0,25 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из …
1) Cd (Е0 = − 0,40 В) 2) Ti (Е0 = − 1,63 В)
3) Ag (Е0 = + 0,80 В) 4) Zn (Е0 = − 0,76 В)
Решение. ЭДС гальванического элемента равна алгебраической разности потенциалов анода и катода и наибольшей эта величина будет в случае титанового анода:
ЭДС= Е катода − Е анода = (−0,25 В) − (−1,63 В) = 1,38 В.
ЛЕКЦИЯ №1 (доп. материал) ЛЕКЦИЯ № 1 |
|
1 Стандартный электродный потенциал Е0 – это электродный потенциал, измеренный при стандартных условиях:
Абсолютное значение электродного потенциала измерить не возможно!!! Поэтому электродные потенциалы измеряют относительно стандартного водородного электрода, выбранного в качестве электрода сравнения, потенциал которого в стандартных условиях принят равным нулю, хлоридсеребряный, каломельный и другие электроды, потенциалы которых измеряют по отношению к водородному электроду. |
|
3 Выводы из ряда напряжения: 1. Ме –это элементы, которые за счет отдачи электронов являются восстановителями. Восстановительная способность Ме зависит от их активности. Чем меньше Е0, тем Ме являются более активными, поэтому все левее стоящие Ме в ряду напряжения способны вытеснять правее стоящие Ме из растворов их солей. 2. Ме стоящие в ряду активности левее (Н) способны восстановить (Н) из кислот (исключение: азотная и азотистая кислоты). Из HNO3 и HNO2 кислот происходит восстановление оксидов азота I или II. НАПРИМЕР: Ме (акт.)+ HNO3 (разб.)→ соль + оксид азота (I) + вода; Ме (акт.)+ HNO3 (конц.)→ соль + оксид азота (II) + вода; 3. Ме стоящие в ряду активности правее (Н) не способны восстановить (Н) из кислот (исключение: азотная и азотистая кислоты). Из HNO3 и HNO2 кислот происходит |
восстановление оксидов азота II или IV. НАПРИМЕР: Ме (пас.)+ HNO3 (разб.)→ соль + оксид азота (II) + вода; Ме (пас.)+ HNO3 (конц.)→ соль + оксид азота (IV) + вода; |
Лекция № ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА |
|
1. При работе гальванического элемента, состоящего из серебряного и медного электродов, погруженных в 0,01 М растворы их нитратов Е°Ag+/ Ag0 = + 0,80 B; Е°Cu2+/ Cu0 = + 0,34 B. на аноде протекает реакция, уравнение которой имеет вид 1) Ag0 − ē → Ag+ 2) Ag+ + ē → Ag0 3) Cu2+ + 2ē → Cu0 4) Cu0 − 2ē → Cu2+
|
2. Если гальванический элемент содержит стандартный никелевый электрод (Е0 = − 0,25 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из … 1) Cd (Е0 = − 0,40 В) 2) Ti (Е0 = − 1,63 В) 3) Ag (Е0 = + 0,80 В) 4) Zn (Е0 = − 0,76 В) Решение. ЭДС гальванического элемента равна алгебраической разности потенциалов анода и катода и наибольшей эта величина будет в случае титанового анода: ЭДС= Е катода − Е анода = (−0,25 В) − (−1,63 В) = 1,38 В.
|
Лекция № АККУМУЛЯТОРЫ |
|
Достоинство свинцового аккумулятора:
Недостатки свинцового аккумулятора:
|
|
Щелочные никель-кадмиевые аккумуляторные батареи
|
|
|
Достоинство щелочного аккумулятора:
Недостатки щелочного аккумулятора:
|
