
- •Диаграммы состояния бинарных систем. Закон Рауля. Диаграммы «давление - состав»,
- •Второй закон Коновалова.
- •Жидкие смеси с неограниченной растворимостью компонентов. Смеси, подчиняющиеся закону Рауля (идеальные смеси): давление и состав пара. Диаграмма «давление – состав».
- •Анализ диаграмм азеотропных смесей.
- •Фракционная перегонка неограниченно смешивающихся жидкостей.
- •Простая перегонка.
- •Взаимно нерастворимые жидкости.
- •Экстракция.
- •Некоторые основные понятия жидкостной экстракции
- •Экстракционное равновесие
- •Использование процессов экстракции в фармацевтическом анализе
- •Диаграммы плавкости.
- •Диаграмма плавкости
- •Применение диаграмм плавкости.
ЛЕКЦИЯ № 5 – 6
Диаграммы состояния бинарных систем. Закон Рауля. Диаграммы «давление - состав»,
«температура - состав» для неограниченно смешивающихся жидкостей. Первый закон Коновалова. Фракционная перегонка неограниченно смешивающихся жидкостей. Азеотропные смеси.
Второй закон Коновалова.
Фазовое равновесие раствор-пар растворителя (закон Рауля)
И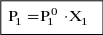 спарение
зависит от температуры и площади
поверхности растворителя. В растворах
часть поверхности занята молекулами
растворенного вещества, что препятствует
испарению молекул растворителя. Кроме
того, растворенные молекулы способны
удерживать вокруг себя молекулы
растворителя (процесс сольватации или
гидратации) и не дают им испаряться. Все
это приводит к тому, что давление пара
над раствором оказывается меньше, чем
над чистым растворителем (закон Рауля)
спарение
зависит от температуры и площади
поверхности растворителя. В растворах
часть поверхности занята молекулами
растворенного вещества, что препятствует
испарению молекул растворителя. Кроме
того, растворенные молекулы способны
удерживать вокруг себя молекулы
растворителя (процесс сольватации или
гидратации) и не дают им испаряться. Все
это приводит к тому, что давление пара
над раствором оказывается меньше, чем
над чистым растворителем (закон Рауля)
(1)
где Р10 – давление пара над чистым растворителем.
Формулировка закона Рауля: давление пара над раствором какого-либо компонента пропорционально молярной доле этого компонента в растворе.
Закон Рауля можно сформулировать и через молярную долю растворенного вещества: относительное понижение давления пара над раствором по сравнению с чистым растворителем равно молярной доле растворенного вещества.
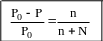 Р0
– давление пара чистого растворителя (2) Р
– давление пара раствора
Р0
– давление пара чистого растворителя (2) Р
– давление пара раствора
n – число молей растворенного вещества
N – число молей растворителя
![]() - молярная доля
растворенного вещества
- молярная доля
растворенного вещества
Понижение давления пара растворителя над раствором влияет на температуру кипения и замерзание раствора. При температуре кипения давление пара над жидкостью должно быть равно внешнему давлению, а при температуре замерзания – давлению пара над затвердевшей жидкостью. Снижение давления пара приводит к необходимости нагревать раствор до более высокой температуры, чтобы достигнуть давления, при котором закипает чистая жидкость, и наоборот, охлаждать до более низкой температуры.
2-й закон Рауля (следствие из закона Рауля)
Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества.

(4)
Δtкип. = tкип. раствора - tкип. растворителя
Δtзам. = tзам. растворителя - tзам. раствора
Е – эбуллиоскопическая константа
К – криоскопическая константа
(Е, К – приводятся в таблицах, зависят от растворителя, но не зависят от растворенного вещества)
Сm – моляльная концентрация
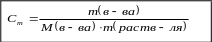
(5)
На измерении повышения температуры кипения и понижения температуры замерзания растворов основаны методы исследования – эбуллиометрия (другое название - эбулиоскопия) и криометрия (криоскопия). Они применяются для определения молярных масс, степени диссоциации и ассоциации различных веществ.
Жидкие смеси с неограниченной растворимостью компонентов. Смеси, подчиняющиеся закону Рауля (идеальные смеси): давление и состав пара. Диаграмма «давление – состав».
Если жидкости 1 и 2 близки по химическим свойствам (например, смесь изомеров или гомологов), то взаимодействие между однородными частицами (1- 1, 2 - 2) такой же силы, что и между разнородными (1 - 2). В этом случае образование раствора происходит без изменения объема и не сопровождается заметным тепловым эффектом. Полученный раствор (смесь) называется идеальным и во всей области концентраций он подчиняется закону Рауля.
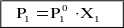
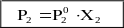
(6) (7)
Пусть 1 – менее летучая жидкость
2 – более летучая жидкость
т.е. у жидкости 1 ниже давление пара над чистым веществом.
Р10 < Р20
Для идеальной смеси общее давление пара над раствором равно сумме давления обоих компонентов
Р0 = Р1 + Р2 = Р10 ·Х1 + Р20 · Х2 = (1-Х2)·Р10 + Р20 · Х2

Р0 = Р10 + Х2(Р20 - Р10) (8)
Таким образом, общее давление пара над смесью линейно зависит от состава пара.
На рисунке (1) представлена зависимость парциальных давлений и общего давления пара от состава смеси при постоянной температуре для системы 1-2
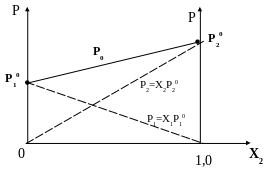
Рисунок 1
По оси абсцисс отложена молярная доля в жидкой фазе более летучего компонента, пунктирными линиями парциальные давления паров каждого компонента и сплошной линией – общее давление пара над смесью.
Чтобы определить состав пара обозначим молярные доли каждого вещества в паре штрихом.
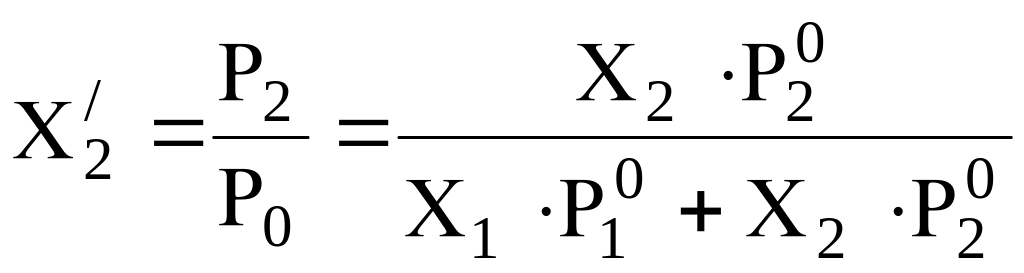 (9)
(9)
Разделим числитель и знаменатель на Р20, получаем
![]()

(10)
(т.к. 1 компонент менее летучий)

Так как Х1
+ Х2 = 1, то Х1ξ1
+ Х2< 1![]() Х2'> Х2
Х2'> Х2
Таким образом, доля второго (более летучего компонента) в паре выше, чем в жидкой смеси. В этом заключается первый закон Коновалова:
по сравнению с жидкой фазой, состав газовой фазы обогащен более летучим компонентом.
На диаграмме (рисунок 2) кроме линии Ж (зависимости Р0 от состава жидкой смеси) изображают линию которая связывает Р0 с составом газовой фазы Х2/ (линия n)
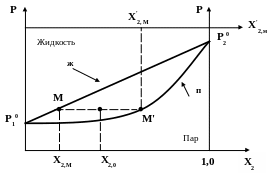
О
Рисунок 2
Для этого вводят дополнительную координатную ось Х2/ , где откладывают молярную долю более летучего компонента в газовой фазе.
Для произвольно
выбранной точки М на линии ж которой
соответствует состав Х2,м
по формуле (9) рассчитывают молярную
долю в газовой фазе, получают соответствующее
значение
![]() (причем
>
Х2,м ), опускаем перпендикуляр
до пересечения с изобарой проходящей
через т. М. на диаграмме получаем
точку М/, принадлежащую
линии n.
(причем
>
Х2,м ), опускаем перпендикуляр
до пересечения с изобарой проходящей
через т. М. на диаграмме получаем
точку М/, принадлежащую
линии n.
Линиями ж и n диаграмма делится на 3 области. Над линией ж только жидкая фаза. Между линиями возможно существование двух фаз: жидкой и газообразной.
Например, в точке
О – состав жидкой фазы
![]() ,
состав газовой
.
Под линией n система
имеет только газовую фазу.
,
состав газовой
.
Под линией n система
имеет только газовую фазу.
Диаграмма «температура - состав»
Если компоненты смеси различаются и по своей летучести Р10< Р20, то они различаются по температурам кипения Тк.1>Т2. Для смеси температура кипения будет зависеть от ее состава.
Рисунок 3

С ростом доли более летучего компонента, т.е. с ростом Х2 температура смеси будет уменьшаться от Тк.1 до Тк.2. на диаграмме это нижняя линия ж (зависимость нелинейная). Таким образом, линия ж показывает зависимость температуры кипения от состава жидкой фазы. Линия n, верхняя линия на диаграмме, показывает состав пара, находящегося в равновесии с жидкостью при любой температуре. Диаграмма опять разделяется на 3 области, но в отличие от предыдущей диаграммы порядок расположения обратный:
Область пара – над линией n
Область жидкой фазы – под линией ж.
Область между этими двумя линиями соответствует гетерогенному равновесию жидкость – пар. Любой точке (например, точке О) находящейся внутри области отвечает жидкость состава К и пар состава К/.
Относительное количество жидкой и парообразной фаз можно вычислить по правилу рычага: отрезок ОК, примыкающий к нижней («жидкостной») линии, пропорционален массе газовой фазы, а отрезок ОК/, примыкающий к верхней («газовой») линии – массе жидкой фазы.
![]()
Неидеальные смеси (смеси, отклоняющиеся от закона Рауля)
Если существуют взаимодействия между частицами, составляющими раствор, то в растворе наблюдаются отклонения от закона Рауля. Положительные отклонения присущи системам, в которых взаимодействие между однородными частицами 1-1, 2-2 больше, чем между разнородными 1-2. Давление пара над системой оказывается большим, чем вычисленное по формуле (8). Реже наблюдаются отрицательные отклонения от закона Рауля, которые проявляются в том, что силы взаимодействия между 1-1, 2-2 меньше чем 1-2. В этом случае давление пара над системой оказывается меньше, чем вычисленное по формуле (8).
Рисунок 4
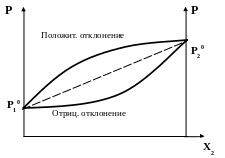
Если отклонения от идеальности достаточно велики, или если вещества имеют близкие значения давления пара, то на диаграммах «давление - состав» может появиться максимум при положительных отклонениях от закона Рауля (рис. 5а) или минимум при отрицательных отклонениях (рис 5б)
Рисунок 5 (а) Рисунок 5 (б)
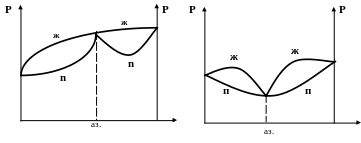
К таким системам применим второй закон Коновалова:
точка максимума или минимума на диаграмме общего давления отвечает раствору, состав которого совпадает с составом равновесного с ним пара. При этом максимум на диаграмме давления соответствует минимуму диаграмме кипения.
Р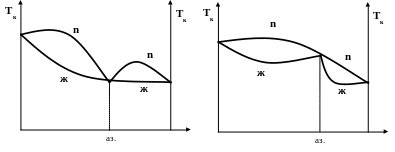 исунок
6 (а) Рисунок
6 (б)
исунок
6 (а) Рисунок
6 (б)
Растворы, отвечающие по составу этим экстремальным точкам, называется азеотропными (или нераздельнокипящими или неразгонными). Состав их при кипении не меняется, и температура кипения при заданном давлении остается постоянной.
