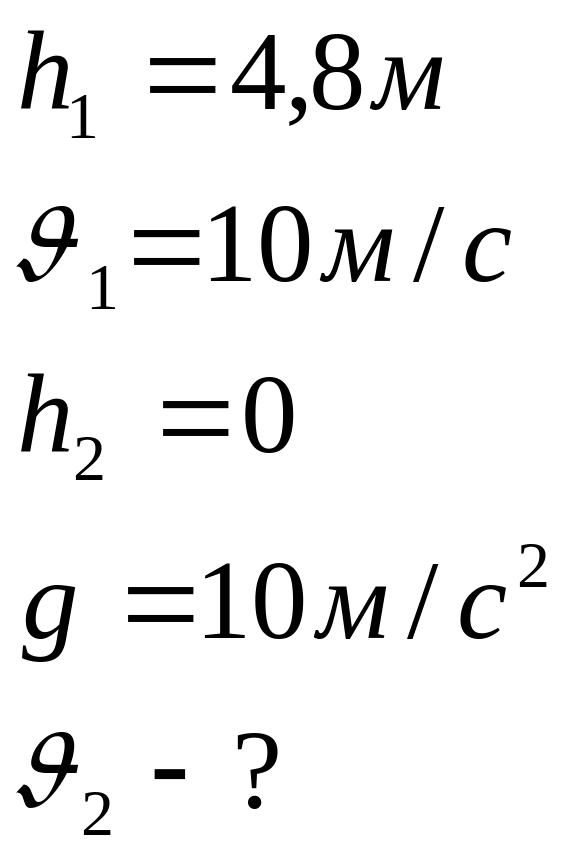- •Билет № 1
- •Относительность механического движения, система отсчета, инерциальные системы отсчета. Принцип относительности в классической механике и теории относительности.
- •Электрический заряд. Закон сохранения заряда, Закон Кулона
- •Билет № 2
- •Электрическое поле, Напряженность электрического поля.
- •Работа при перемещении заряда в электрическом поле. Разность потенциалов.
- •Билет № 5
- •Соединение конденсаторов в батарею. Энергия заряженного конденсатора. Применение конденсаторов.
- •Билет № 6
- •Электрический ток. Условие существования тока. Сопротивление. Закон Ома для участка цепи.
- •1.Сила трения. Коэффициент трения скольжения. Учет и использование трения в быту и технике.
- •Сопротивление. Зависимость сопротивления металлов от материала и размеров. Зависимость сопротивления от температуры. Сверхпроводимость.
- •Задача. А) По проводнику сопротивлением 20 Ом за 5 минут прошло 300 Кл электричества. Вычислить работу тока за это время.
- •Билет № 9
- •Кинетическая энергия. Закон сохранения энергии в механических процессах.
- •Электрический ток в электролитах. Электролиз. Закон электролиза.
- •Билет № 10
- •Электродвижущая сила. Закон Ома для полной цепи.
- •Билет № 11
- •Свободные электромагнитные колебания . Колебательный контур .Превращение энергии в колебательном контуре.
- •Радиоактивность. Виды радиоактивных излучений.
- •Билет № 12
- •Электронно-дырочный переход и его свойства. Полупроводниковые приборы и их применение.
- •Термоэлектронная эмиссия и её использование в электронно-вакуумных приборах. Электронно-лучевая трубка
- •Билет № 14.
- •Электрический ток в газах. Несамостоятельный и самостоятельный газовый разряд. Виды и применение самостоятельных разрядов.
- •Билет № 15
- •2. Магнитное поле. Источники магнитного поля. Индукция магнитного поля.
- •Билет № 16
- •М олекулы, основное уравнение можно записать в виде
- •Сила Ампера. Сила Лоренца. Правило левой руки.
- •Лабораторная работа. Определение удельного сопротивления проводника.
- •Билет № 17
- •Изопроцессы. Газовые законы.
- •Магнитные свойства вещества. Ферромагнетики и их применение.
- •Билет № 18
- •Электромагнитные волны и их свойства. Радиолокация и её применение.
- •Билет № 19
- •Спектр электромагнитных излучений. Зависимость свойств излучений от частоты. Применение излучений.
- •Билет № 20
- •Модель атома Резерфорда – Бора. Квантовые постулаты Бора.
- •Билет № 21
- •Работа при изобарном расширении газа. Графический смысл работы.
- •Явление электромагнитной индукции. Закон электромагнитной индукции, Правило Ленца.
- •Задача.
- •Билет № 22
- •Тепловые двигатели. Принцип работы. Роль нагревателя, рабочего тела, холодильника.
- •2. Самоиндукция. Индуктивность. Энергия магнитного поля.
- •3. Задача.
- •Билет № 23
- •Кпд тепловых двигателей. Второе начало термодинамики.
- •Физические основы радиопередачи.
- •Билет № 24
- •Простейший радиоприемник
- •Билет № 25
- •Внешний и внутренний фотоэффект. Законы внешнего фотоэффекта.
- •Билет № 26
- •Кванты света. Теория фотоэффекта. Применение фотоэффекта.
- •Билет № 27
- •2. Состав атомного ядра. Ядерные силы. Энергия связи ядер.
- •3. Задача
- •(2) Электродвижущая сила. Закон Ома для полной цепи.
- •(2) Явление электромагнитной индукции. Закон электромагнитной индукции, Правило Ленца.
- •22(2.) Самоиндукция. Индуктивность. Энергия магнитного поля.
- •26(1) Трансформатор, его устройство и принцип работы. Передача электроэнергии.
Билет № 20
Первое начало термодинамики. Первое начало в изопроцессах.
Первое начало термодинамики – это закон сохранения и превращения энергии, распространенный на тепловые процессы. При разнообразных процессах, протекающих в природе, энергия не возникает из ничего и не уничтожается, но превращается из одних видов в другие.
Можно дать такую качественную формулировку первого начала термодинамики: невозможно построить вечный двигатель первого рода. Для количественной формулировки первого начала нужно учесть, что внутреннюю энергию системы можно изменить двумя способами: в процессе теплообмена и при совершении работы.
Количество теплоты Q, переданное системе идет на увеличение внутренней энергии ∆U и на выполнение системой работы над внешними телами А, Q = ∆U +A. Первому закону термодинамики можно дать другую формулировку: Изменение внутренней энергии системы численно равно сумме количества теплоты, переданной системе Q и работы внешних сил А/ над системой, ∆U=Q+A/.
Первый закон термодинамики для изохорного процесса (V= const) принимает вид Q= ∆U, т.е. вся теплота, переданная газу, идет на увеличение внутренней энергии (если система отдает некоторое количество теплоты, то внутренняя энергия системы уменьшается). Первый закон термодинамики для изотермического процесса (Т=const) принимает вид Q=A т.е. вся теплота, сообщенная системе расходуется на работу системы над внешними телами. Первый закон термодинамики для изобарного процесса (p=const) имеет вид Q = ∆U +A
Модель атома Резерфорда – Бора. Квантовые постулаты Бора.
До открытия радиоактивности атомы считались элементарными частицами, неизменными и не имеющими никакого внутреннего строения. Исследования Дж.Дж.Томсона показали, что открытые им электроны появляются в свободном состоянии при ионизации атомов. Это означало, что электроны входят в состав атомов, т. е. атомы имеют какую-то внутреннюю структуру. Неионизированный атом нейтрален, значит отрицательный заряд, входящих в него электронов компенсирован положительным зарядом. Дж.Дж. Томсон предположил, что атомы представляют собой шарообразные частицы, состоящие из положительно заряженного вещества, в которое вкраплены отрицательно заряженные электроны (как изюминки в тесте кекса).
Модель Томсона требовала экспериментальной проверки, её выполнил Эрнест Резерфорд. Испускаемый радиоактивным веществом пучок альфа-частиц направлялся на тонкую металлическую фольгу. Проходя через фольгу, частицы попадали на экран, покрытый сернистым цинком. При этом каждая α- частица вызывала на экране вспышку света (сцинтилляцию), которая фиксировалась с помощью микроскопа. Большинство α- частиц свободно проходили через фольгу или отклонялись на очень малые углы. Но небольшое число α- частиц рассеивались на большие углы, иногда близкие к 1800. В 1911г. Резерфорд, обобщив результаты опытов, пришел к выводу: в центре атома находится положительно заряженное ядро, в котором сосредоточена практически вся масса атома, размер ядра порядка 1·10-15 м (размер атома имеет порядок 10-10 м). Вокруг ядра , как планеты вокруг Солнца, движутся электроны, число которых совпадает с порядковым номером элемента в таблице Менделеева.
Планетарная модель имела две существенные трудности: 1) почему электрон в атоме водорода попадает всегда на одну и ту же орбиту 2) согласно законам классической электродинамики, электрон, движущийся вокруг ядра с центростремительным ускорением, должен непрерывно излучать электромагнитные волны, однако атомы излучают энергию не всегда.
Выход из противоречий между планетарной моделью ядра и законами классической электродинамики был предложен в 1913 г. датским физиком Нильсом Бором. Бор заложил основы квантовой теории атома, объединив планетарную модель атома с гипотезой Планка о прерывистой структуре излучения света веществом. Основы новой теории Бор представил в виде трех постулатов:
1) Электроны в атоме могут двигаться
только по стационарным (разрешенным)
орбитам, удовлетворяющим условию 2![]() rmu
= hn где r -
радиус орбиты, m - масса
электрона, u - скорость
электрона. h – постоянная
Планка, n - главное
квантовое число, означающее номер орбиты
( n = 1, 2,3,…)
rmu
= hn где r -
радиус орбиты, m - масса
электрона, u - скорость
электрона. h – постоянная
Планка, n - главное
квантовое число, означающее номер орбиты
( n = 1, 2,3,…)
2) Каждой стационарной орбите электрона соответствует определенное энергетическое состояние атома. Движение электрона по стационарной орбите не сопровождается излучением или поглощением энергии.
3) Излучение или поглощение фотона сопровождается переходом электрона с одной стационарной орбиты на другую, причем энергия фотона, излученного при переходе из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией ( поглощенного при обратном переходе) равна разности энергии атома в начальном и конечном состояниях hν = E1-E23. Задача.
а) Найти кинетическую и потенциальную энергию тела массой 3 кг, свободно падающего с высоты 5м, на расстоянии 2м от поверхности.
Дано:
|
Решение.
Еп = т. е. Ек = mqH –mqh.
|
б) Тело, падающее на поверхность Земли, на высоте 4,8 м от поверхности имело скорость 10 м/с. С какой скоростью тело упадет на Землю?
Дано:
|
Решение: Система « Земля –тело» является замкнутой, поэтому к этой системе применим закон сохранения механической энергии:
|
Ответ: Тело упадет на Землю со скоростью 14 м/с.