
- •Тема 15(ем). Смеси газов
- •Вопрос 1. Смеси идеальных газов
- •1.1. Давление, объем и масса смеси
- •1.2. Способы задания смеси
- •1.7. Изменение энтропии идеальных газов при смешивании
- •1.8. Смешивание газовых потоков
- •1.9. Заполнение или опорожнении резервуара
- •Вопрос 2. Парогазовые смеси. Влажный воздух.
Тема 15(ем). Смеси газов
Вопрос 1. Смеси идеальных газов
В практике часто приходится иметь дело с газообразным веществом, близким по свойствам к идеальным газам и представляющими собой механическую смесь различных газов, химически не реагирующих между собой.
1.1. Давление, объем и масса смеси
Основным законом, определяющим поведение газовой смеси является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в смесь компонентов
|
Парциальное давление рi – это давление, которое имел бы компонент газа, если бы он один при той же температуре занимал весь объем смеси.
Объем смеси идеальных газов равен сумме приведенных (парциальных) объемов всех входящих в смесь компонентов
![]() .
.
Приведенным (парциальным) объемом
![]() называется объем, который занимал бы
компонент газа, если бы его давление и
температура равнялись давлению и
температуре смеси.
называется объем, который занимал бы
компонент газа, если бы его давление и
температура равнялись давлению и
температуре смеси.
![]() .
.
Масса смеси идеальных газов равна сумме масс всех входящих в смесь компонентов
![]()
1.2. Способы задания смеси
Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношения массы отдельного компонента Мi к массе смеси М
![]() и
и
![]() .
.
Например, для воздуха
![]() 77 %,
77 %,
![]() 23 %.
23 %.
Объемной долей называется отношения приведенного объема компонента газа Vi к полному объему смеси V.
![]() и
и
![]() .
.
Для воздуха
![]() = 78 %,
= 78 %,
![]() = 21 %.
= 21 %.
Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N. Можно показать, что задание смеси газов мольными долями равнозначно заданию ее объемными долями
![]() ,
где
,
где
![]() .
.
1.3. Газовая постоянная и молекулярная масса смеси
Уравнение состояния для смеси
![]() или через компоненты смеси
или через компоненты смеси
 =
=
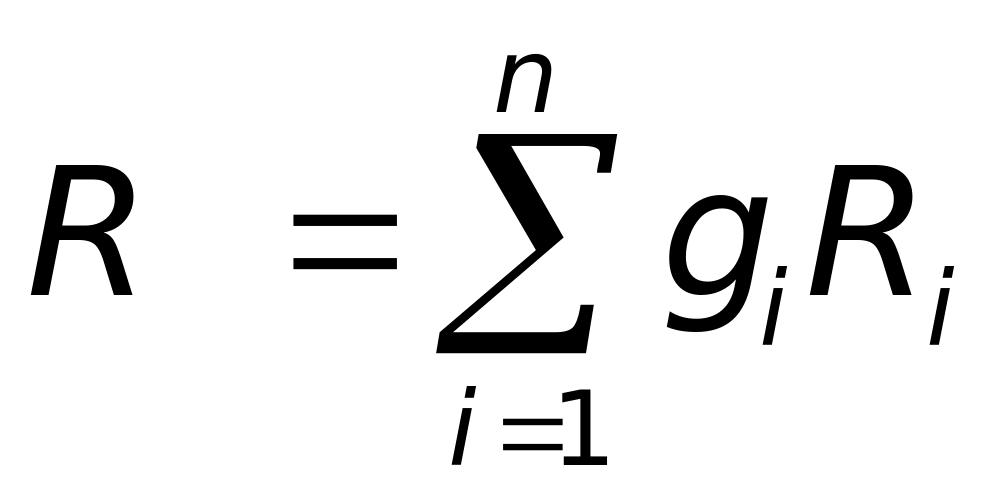 - газовая постоянная смеси.
- газовая постоянная смеси.
Молекулярная масса смеси:
1) через массовые доли:
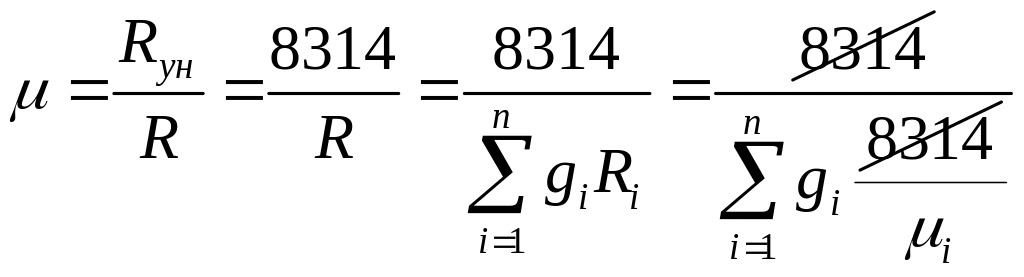 =;
=;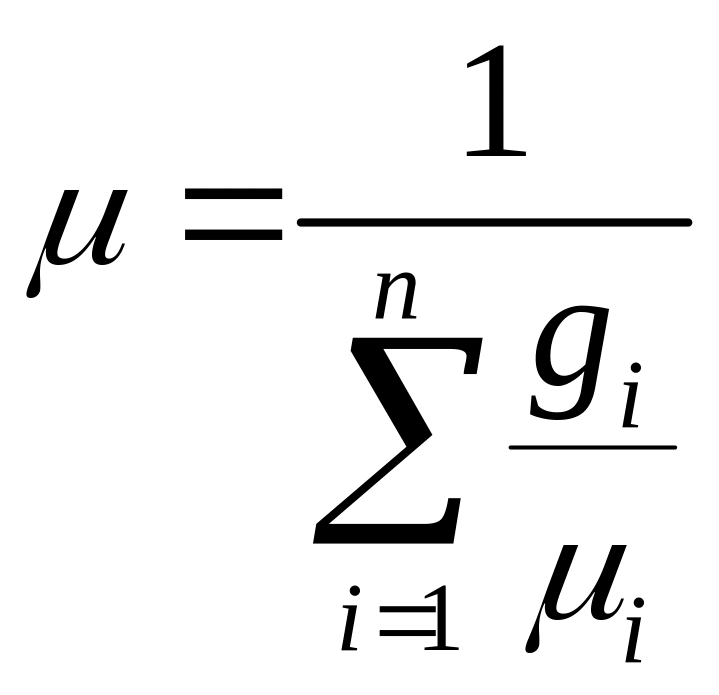 .
.
2) через объемные доли,
так как
![]() ,
то
,
то
 =
=
![]()
1.4. Соотношения между объемными и массовыми долями
 =>
=> и
и
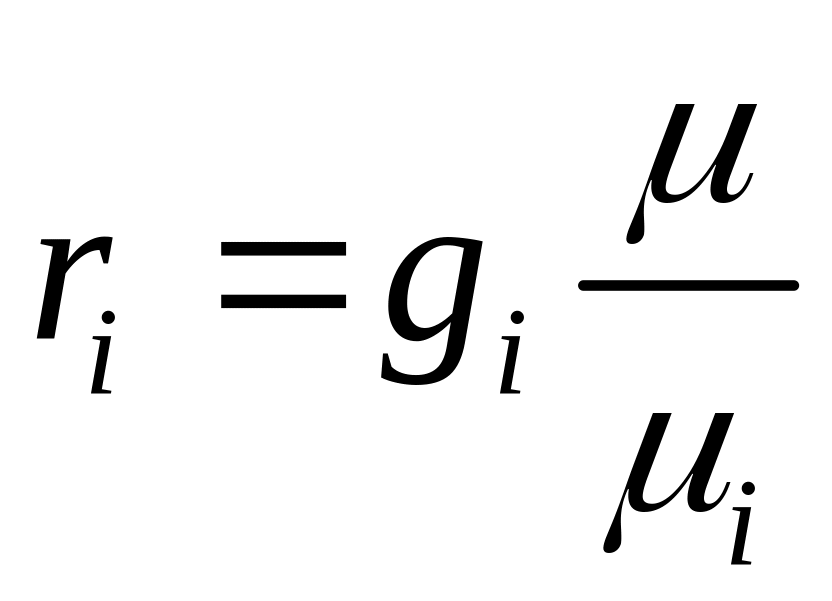
1.5. Теплоемкость смеси
![]() ;
;
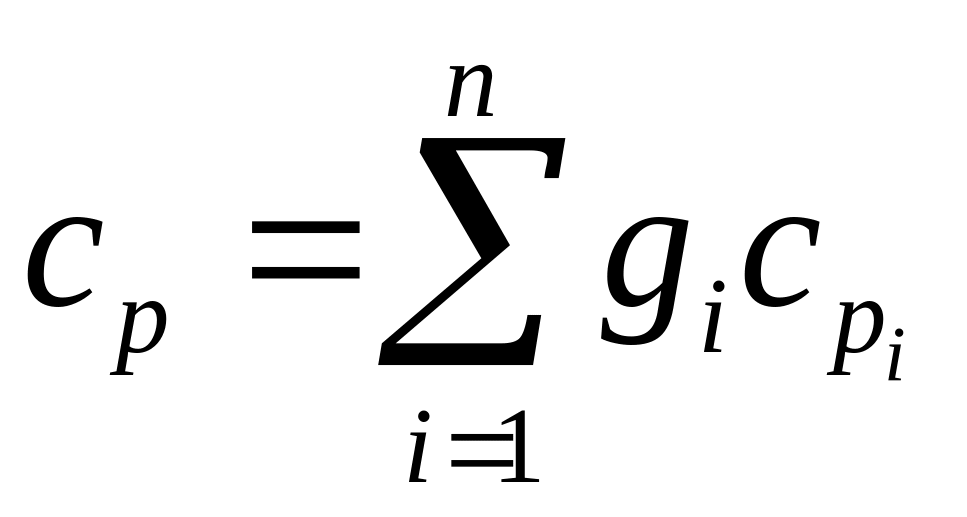 - массовая теплоемкость при v
= const и р = const,
- массовая теплоемкость при v
= const и р = const,
![]() ;
;
![]() - объемная теплоемкость при v
= const и р = const,
- объемная теплоемкость при v
= const и р = const,
![]() ;
;
![]() - мольная теплоемкость при v
= const и р = const.
- мольная теплоемкость при v
= const и р = const.
1.6. Смешивание идеальных газов при постоянном объеме
Пусть несколько газов с давлениями р1, р2, … и температурами Т1, Т2, … занимают различные объемы V1, V2, …
После удаления разделяющих перегородок
объем образовавшейся смеси будет равен
сумме объемов смешиваемых газов:
![]() .
.
Масса смеси газов равна сумме масс
газов, составляющих смесь:
![]()
Предполагается, что при смешение газов
отсутствует теплообмен с внешней средой,
и газы не совершают внешней работы. В
этом случае внутренняя энергия смеси
идеальных газов, согласно первому закону
термодинамики, равна сумме внутренних
энергий отдельных газов до смешения:
![]() .
.
Тогда при
![]() получим
получим
![]() .
.
Откуда температура смеси идеальных газов
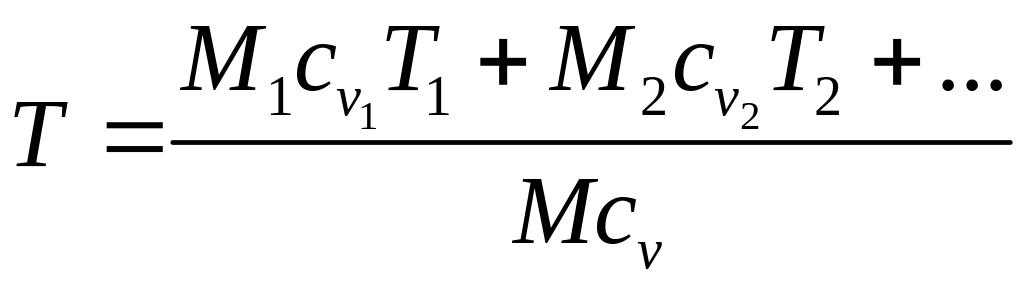 =
= ,
,
где g1, g2 и т.д. – массовые доли идеальных газов, составляющих смесь.
Из полученного уравнения и уравнения состояния идеальных газов можно получить давление смеси газов одинаковой атомности
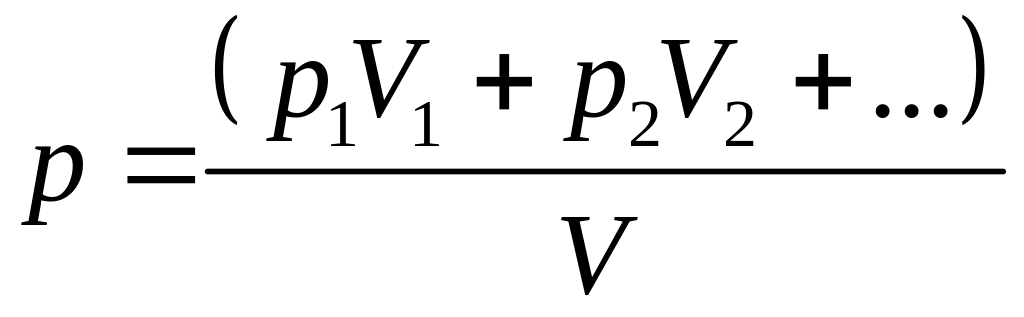 .
.
Зная температуру, объем и давление, можно определить все остальные величины и параметры смеси газов.
