
Л е к ц і я
Тема: Елементи VIII В, ІВ та ІІВ груп.
ПЛАН
Загальна характеристика металів підгрупи Феруму.
Властивості заліза та сполук Феруму. Біологічна роль Феруму та Кобальту.
Загальна характеристика елементів І В групи. Купрум, Аргентум, Аурум, поширення у природі. Біологічна роль елементів. Використання у медицині та фармації сполук Купруму та Аргентуму.
Хімічні властивості міді та сполук Купруму.
Загальна характеристика елементів ІІ В групи. Цинк та його сполуки. Комплексні сполуки d-елементів. Кадмій. Меркурій.
Загальна характеристика металів підгрупи Феруму.
VIIIB група періодичної системи є особливою. На відміну від інших груп вона містить по три елементи у кожному періоді. Це метали, які, по-перше, не мають типових аналогів, а по-друге, не утворюють сполук, ступінь окиснення в яких відповідав би повному числу валентних електронів, а саме — восьми.
До складу VIIIB групи входять дев’ять d-елементів, що об’єднуються у тріаду (родину) феруму Fe, Co, Ni та платинові метали, які містять всі інші елементи групи. У свою чергу, базуючись на аналогії властивостей, платинові метали об’єднуються по два (рутеній Ru — осмій Os, родій Rh — іридій Ir та паладій Pd — платина Pt).
Найбільше значення у фармацевтичній та медичній практиці мають метали тріади заліза.
До тріади феруму відносяться Ферум, Кобальт і Нікол. Fe і Ni – парні елементи, що обумовлює велику плеяду стабільних ізотопів, а Кобальт – непарний (елемент-одинак). Тому атомна маса Нікелю виявилась меншою за атомну масу Кобальту. Слід зазначити, що Д. І. Менделєєв, крім основного критерію розміщення елементів у періодичній системі — величини атомної маси,— використовував закономірність зміни хімічних властивостей відповідних однотипних сполук елементів тріади феруму, що співпадає зі зміною їх валентних електронних конфігурацій.
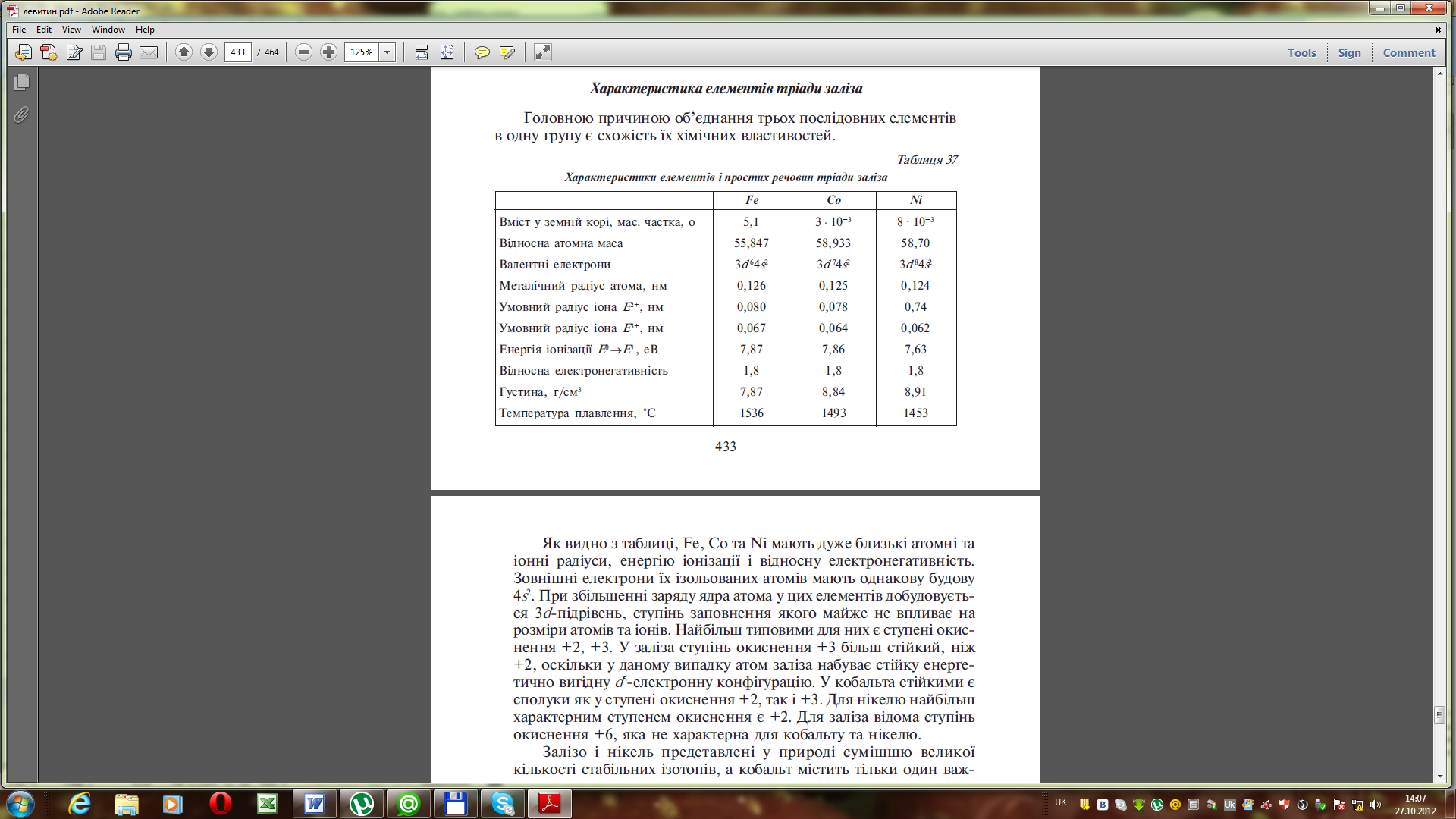
Як видно з таблиці, Fe, Co та Ni мають дуже близькі атомні та іонні радіуси, енергію іонізації і відносну електронегативність.
Зовнішні електрони їх ізольованих атомів мають однакову будову 4s2. При збільшенні заряду ядра атома у цих елементів добудовується 3d-підрівень, ступінь заповнення якого майже не впливає на розміри атомів та іонів. Найбільш типовими для них є ступені окиснення +2, +3. У Феруму ступінь окиснення +3 більш стійкий, ніж +2, оскільки у даному випадку атом Феруму набуває стійку енергетично вигідну d5-електронну конфігурацію. У Кобальта стійкими є сполуки як у ступені окиснення +2, так і +3. Для Нікелю найбільш характерним ступенем окиснення є +2. Для Феруму відома ступінь окиснення +6, яка не характерна для Кобальту та Нікелю.
Ферум – d-елемент VІІІВ групи (або побічної підгрупи VІІІ групи) періодичної системи.
Будова атома:
![]()
Електронна конфігурація атома Феруму: 1s22s22p62s23p63d64s2
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:

В атомі Феруму вісім валентних електонів (3d64s2), тому він виявляє змінні ступені окиснення.
Найхарактерніші ступені окиснення +2 і +3 (відомі сполуки, де Ферум виявляє ступені окиснення, що дорінюють 0, +4, +6).
За поширенням у природі Ферум другий за розповсюдженням метал, який поступається лише Алюмінію, посідає четверте місце після Оксигену, Силіцію, Алюмінію. Трапляється у вигляді різних сполук: оксидів, сульфідів, силікатів та ін. У вільному стані – тільки в метеоритах.
Основні мінерали, що містять Ферум:

або FeO(OH).
Фізичні властивості.
Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза 7,87 г/см3, tпл=1535oС. Має здатність намагнічуватися (феромагнетик).
Хімічні властивості.
Залізо належить до металів середньої хімічної активності:
-взаємодіє з киснем:
![]()
- під час нагрівання взаємодіє з іншими неметалами – хлором, сіркою, вуглецем, азотом:
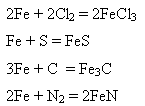
Який відновлюється:
Fe + 2FeCl3 = 3FeCl2,
- у розжареному стані (понад 700ОС) взаємодіє з водою (водяною парою):
![]()
На вологому повітрі та у воді, яка містить кисень, залізо зазнає корозії, воно іржавіє, вкриваючись жовто-бурою плівкою, яка переважно складається із ферум(ІІІ) гідроксиду, але плівка не захищає метал від подальшої корозії:
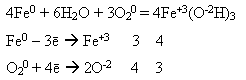
-взаємодіє з хлоридною і розбавленою сульфатною кислотами:
![]()
Розведена азотна кислота окиснює залізо до Fe2+:
4Fe + 10HNO3(р) = 4Fe(NO3)2 + NH4NO3 + 3H2O.
Концентровані сульфатна і нітратна кислоти пасивують залізо, що дає змогу зберігати і перевозити їх у залізних цистернах.
При нагріванні у концентрованій сульфатній кислоті залізо розчиняється і утворює сполуки зі ступенем окиснення +3:
2Fe + 6H2SO4(к)= Fe2(SO4)3 + 3SO2 + 6H2O
Залізо відновлює менш активні метали з розчинів їхніх солей:
Fe + CuSO4 = FeSO4 + Cu
- у подрібненому вигляді залізо може взаємодіяти з концентрованим гарячим розчином лугу з утворенням комплексних гідроксисолей:
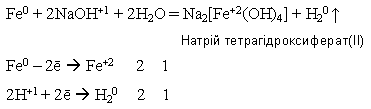
У нульовому ступені окиснення залізо з карбоном (ІІ) оксидом при підвищеному тиску і нагріванні до 100–200 °С. утворює карбоніл: [Fe(CO)5].
Пентакарбонілферум [Fe(CO)5] — жовта летка рідина (tпл=–20 °С,tкип = +103 °С), розчинна у бензолі та ефірі і нерозчинна у воді. Як ліганд сильного поля, CO спарює валентні електрони атома феруму, і воно, як акцептор у стані dsp3-гібридизації АО, утворює п’ять σ-зв’язків з неподіленими електронними парами молекул CO і чотири π-зв’язки з молекулами CO як донора неподілених електронних пар.
Оксиди і гідроксиди Феруму
Ферум утворює три оксиди і два гідроксиди:

Сполуки Феруму(ІІ).
Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені, тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості:
FeO + 2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + H2O
Ферум(ІІ) оксид чорного кольору з лугами не взаємодіє.
Синтезують його відновлюючи феруму (ІІІ) оксид:
Fe2O3 + H2=2FeO + H2O.
Ферум(ІІ) гідроксид, якщо він свіжодобутий і під час кип’ятіння реагує з концентрованим розчином лугу:
Fe(OH)2 + 2NaOH = Na2[Fe(OH)4] Натрій тетрагідроксиферат(ІІ)
Ферум(ІІ) гідроксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІ):
![]()
Саме так відбувається реакція без доступу повітря. У протилежному разі ферум(ІІ) гідроксид легко окиснюється до ферум(ІІІ) гідроксиду:
![]()
Гідроксиди Феруму(ІІ) під час нагрівання розкладається:
Fe(OH)2 = FeO + H2O
Найбільш важливі солі феруму (II)
При випарюванні з водних розчинів зазвичай утворюються кристалогідрати зеленого кольору, наприклад: FeSO4·7H2O (залізний купорос), Fe(ClO4)2·6H2O, Fe(NO3)2·6H2O, (NH4)2Fe(SO4)2 ·6H2O (сіль Мора). Сіль Мора найстійкіша на повітрі. Вона не втрачає воду, мало окиснюється, її використовують для приготування стандартних розчинів феруму(II).
Для феруму(II) найбільш типовим є координаційне число 6, що відповідає октаедричному розташуванню зв’язків у комплексі. В основі більшості кристалогідратів лежить структурна одиниця [Fe(OH2)6]2+ катіон гексаакваферуму (II). Навіть у залізному купоросі існує октаедрична симетрія: FeSO4·7H2O або [Fe(OH2)6]SO4·H2O.
У координаційну сферу феруму (II) в FeCl2·6H2O, крім чотирьох молекул H2O, входять іони Cl– (у транс-положенні) [Fe(OH2)4Cl2] ·2H2O.
Солі феруму (II) у водних розчинах гідролізуються:
Fe2+ + H2O = FeOH+ + H+.
Солі феруму(II) мають відновні властивості:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O.
Аніонні комплекси заліза(II) — загалом малостійкі. Найбільш стійким є гексаціаноферат(II) калію K4[Fe(CN)6]. Він утворюється при взаємодії:
FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4.
Міцність [Fe(CN)6]4– пояснюється тим, що CN–-іони є лігандами сильного поля, які очолюють спектрохімічний ряд і утворюють низькоспинові комплекси з внутрішньоорбітальною d2sp3-гібридизацією, стійкість яких досить висока. K4[Fe(CN)6] — жовта кров’яна сіль, її використовують в аналітичній практиці для виявлення іонів Fe3+.

Сполуки Феруму(ІІІ).
Оксид і гідроксид Феруму(ІІІ) мають більш виражені амфотерні властивості:
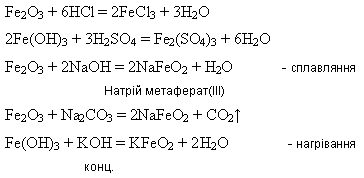
Дією води ферити повністю гідролізуються:
NaFeO2 + 2H2O = Fe(OH)3 + NaOH.
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(ІІ) пояснюється збільшенням ковалентності зв’язку Fe – O із підвищенням ступеня окиснення Феруму.
Ферум(ІІІ) гідроксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ):
![]()
Гідроксиди Феруму (ІІІ) під час нагрівання розкладається:
2Fe(OH)3 = Fe2O3 + 3H2O
Подвійний (змішаний) оксид.
Під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і Феруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2
Під час взаємодії з нітратною кислотою утворюється лише одна сіль – ферум(ІІІ) нітрат внаслідок окиснення сполук Феруму(ІІ) до сполук Феруму(ІІІ):
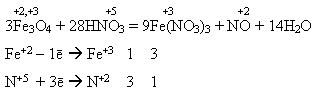
Координаційні числа Fe(III) дорівнюють 6, рідше — 4, що відповідає октаедричному та тетраедричному комплексу.
У водному розчині солі феруму(III) утворюють гексааквакомплекс[Fe(OH2)6]3+ червоно-бурого кольору. Інтенсивність забарвлення змінюється в залежності від ступеня гідролізу.
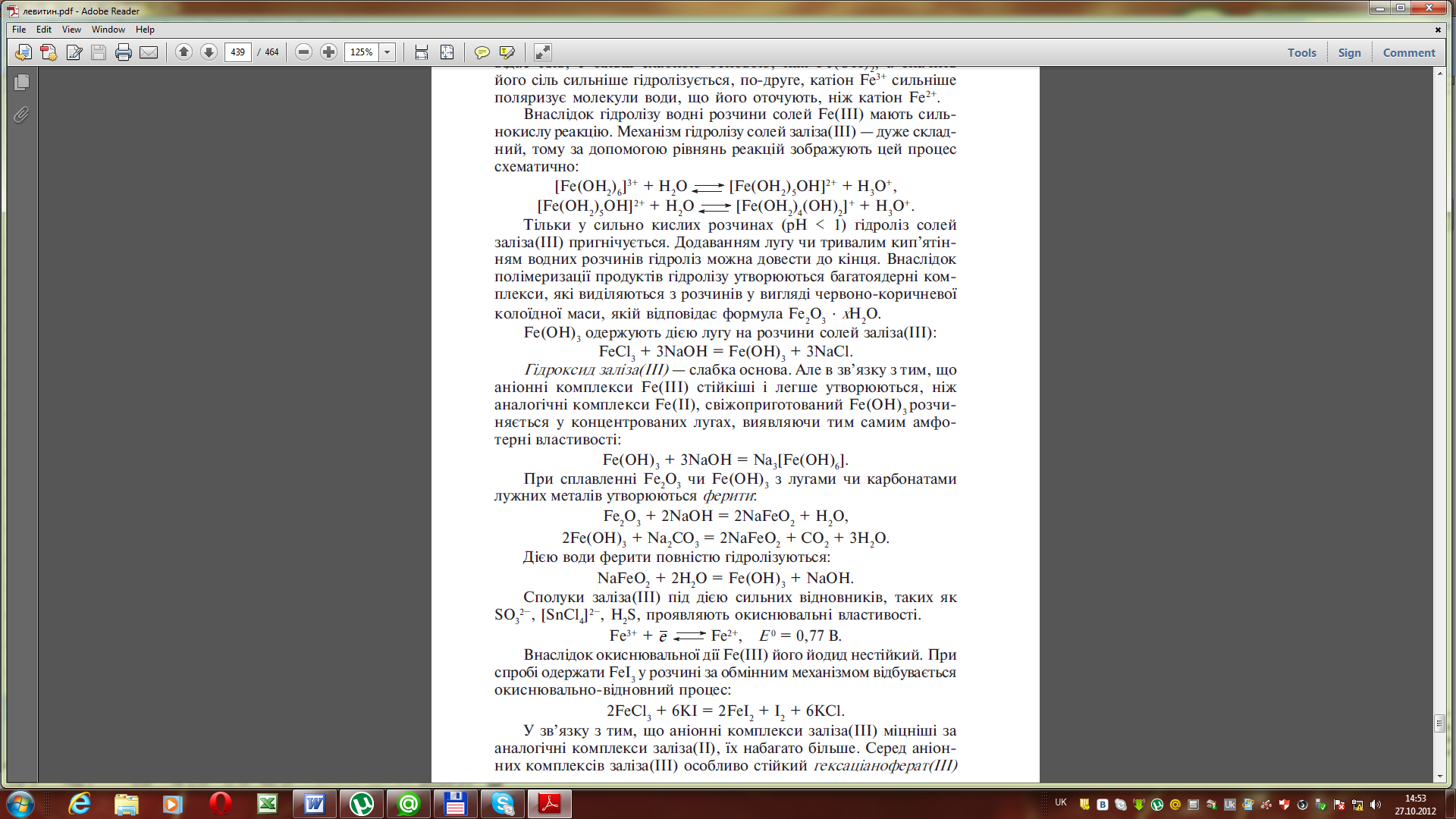
Солі феруму (III) гідролізовані сильніше, ніж солі феруму(II). Поперше, це пов’язано з тим, що феруму (ІІІ) гідроксид, якому відповідає сіль, є більш слабкою основою, ніж Fe(OH)2, а значить його сіль сильніше гідролізується, по-друге, катіон Fe3+ сильніше поляризує молекули води, що його оточують, ніж катіон Fe2+.
Внаслідок гідролізу водні розчини солей Fe(III) мають сильнокислу реакцію. Механізм гідролізу солей заліза(III) — дуже складний, тому за допомогою рівнянь реакцій зображують цей процесс схематично:


Біологічна роль Феруму та Кобальту.
Ферум має велике біологічне значення. Загальна його масова частка в організмі людини складає 1 10–5 %, це близько 4–5 г,в тому числі 60–73 % у складі гемоглобіну, а також у дихальних ферментах цитохромах, які приймають участь у переносі електронів.
Добова потреба організму у Ферумі складає 15–20 мг. Загальна його кількість потрапляє в організм людини з рослинною їжею та м’ясом.
Головна функція Феруму полягає в тому, що воно у складі гемоглобіну приймає участь в переносі кисню від органів дихання до тканин і діоксиду вуглецю від тканин до дихальних органів. Гемоглобін складається з білкової частини (глобіну) та залізопорфірину — гему, в якому Ферум знаходиться у ступені окиснення +2. Процес переносу кисню не супроводжується окисненням Феруму.
При втраті крові, вагітності, пологах і менструаціях потреба у Ферумі перевищує кількість, яку людина отримує з їжею. Нестача його в організмі може привести до залізодефіцитної анемії (недокрів’я) — стану, який характеризується зменшенням кількості еритроцитів та гемоглобіну крові.
Препарати заліза широко використовують в медичній практиці як протианемічні засоби. Основою таких препаратів як фероплекс, феромед, ферлецид та феро-градумент є сульфат заліза(II) в комплексі з фолієвою та аскорбіновою кислотою, вітамінами та вуглеводами, які сприяють його засвоєнню. Провізор, відпускаючи хворому вищезазначені препарати, повинен попередити, що такі продукти харчування, як яйця та молоко перешкоджають процесу засвоєння заліза.
Кобальт — мікроелемент, який різнобічно впливає на життєві процеси організму людини: на білковий, жировий, вуглеводний та мінеральний обміни. Кобальт у вигляді вітаміну В12 (ціанкобаламіну) приймає участь у синтезі гемоглобіну, і його нестача викликає важку анемію. Найбільш багатий вітаміном В12 такий харчовий продукт, як печінка тварин. Радіоактивний кобальт 60Co (у вигляді кобальтової гармати) використовують у медицині для лікування злоякісних пухлин. При надлишку кобальту він стає токсичним. Тому на деяких іграшках, у виробництві яких використовують кобальтвмісні барви, позначають «для дітей не молодше 3-х років!».
Загальна характеристика елементів ів групи. Купрум, Аргентум, Аурум, поширення у природі. Біологічна роль елементів.
До елементів ІВ групи періодичної системи належать Купрум Сu, Аргентум Ag та Аурум Аu. Усі вони є d-елементами, атоми їх містять на d-підрівні 10 електронів і на s-підрівні – 1 електрон в стані d10ns1. При збудженні один електрон може переходити d9ns1nр1. Завершеність “передзовнішнього” електронного d-підрівня обумовлює специфічність фізичних і хімічних властивостей елементів підгрупи Купруму, насамперед простих речовин – металів.
Завдяки наявності одного s-електрона у зовнішньому шарі ці елементи мають характерний ступінь окиснення +1, томущо відносно легко відбувається збудження та перехід електронів із d- на s-підрівень, елементи підгрупи Купруму можуть утворювати сполуки у ступенях окиснення +2 та +3.
Виходячи з цього ступінь окиснення +1 – Ag, +2 – Cu, +3 – Au.
Вони мало схожі на лужні метали. Усі вони мають здатність до комплексоутворення. Як і для більшості d-елементів із збільшенням ступеня окиснення тенденція до утворення аніонних комплексів зростає. Залежно від ступеня окиснення елементів їх координаційні числа у комплексах змінюються від 2 до 6.
Для елементів підгрупи Купруму характерна мала хімічна активність. Порівняно з лужними металами вони характеризуються набагато більшим значенням першого потенціалу іонізації, відносної електронегативності.
Поширення в природі елементів ІВ групи
Усі елементи ІВ групи належать до малопоширених у земній корі. Вони існують як у вільному стані, так і у вигляді сполук.
Купрум:
Cu2S - мідний блиск (халькозин),
CuFeS2 — мідний колчедан, халькопірит
Си2О — куприт, червона руда
СиСО3 · (СиОН)2 – малахіт
2CuCO3· (СиОН)2 – азурит
Cu2FeS3 - борніт
З оксигеновмісних руд мідь безпосередньо відновлюють вугіллям (коксом), а сульфідні руди перш за все випалюють на повітрі. До утвореного при цьому рідкого шлаку, який містить Cu2S, додають флюс та продувають повітрям. Внаслідок цього відбувається вигоряння сірки та виділення металічної міді. «Вороновану» мідь очищають електролізом.
При одержанні міді гідрометалургічним способом руду спочатку обробляють сірчаною кислотою, потім виділяють мідь шляхом електролізу.
Аргентум
- Ag2S – аргентит,
а також в поліметалічних рудах, частіше, сульфідних (Ag3SbS3, Ag3AsS3)
Саморідне срібло зустрічається дуже рідко.
Аурум
В основному в самородному стані, а також у домішках поліметалічних руд.
Біологічна роль Купруму, Аргентуму і Ауруму
Купрум належить до життєво необхідних мікроелементів та відіграє важливу біологічну роль в усіх процесах, які протікають в організмі людини. Загальна масова частка купруму в органах та тканинах людини складає 1·10-4%.
Як правило, в жіночому організмі купруму більше, ніж у чоловічому. У дитячому організмі купруму міститься у три рази більше, ніж у дорослому, що визначається більшою інтенсивністю процесу метаболізму. Найбільший вміст купруму зосереджений у жовчному міхурі та печінці.
Купрум специфічно діє на синтез гемоглобіну та утворення еритроцитів. Солі купруму позитивно впливають на ріст та розвиток організму, приймаючи участь у білковому обміні. Добова потреба в Купрумі близько 2 мг, вона з надлишком перекривається, якщо в раціоні харчування людини є теляча печінка, хліб грубого помолу, насіння стручкових рослин. Велика кількість купруму міститься у дріжджах.
В організмі людини Купрум утворює комплексні сполуки з біологічно активними субстратами — амінокислотами та білками, сприяючи процесам кровотворення, утворення кісткової тканини, розумовому та фізичному розвитку. Комплекси купруму з багатьма лікарськими препаратами підвищують їх фармакологічну активність.
Сульфат купруму(II) використовують як зовнішній антисептичний, в'яжучий або припікаючий засіб у вигляді розчинів з масовою часткою 0,25 % в очній та урологічній практиці.
Аргентум. Фізіологічна та біологічна роль аргентуму мало вивчена. Залежно від концентрації аргентум здійснює в'яжучу, припікаючу, протизапальну та бактерицидну дію.
Аргентуму нітрат AgNO3 у вигляді водних розчинів з масовою часткою 1-2 % використовують як антисептичний засіб зовнішньо для лікування очних хвороб та захворювань шкіри. Колоїдні розчини Аргентуму — протаргол (комплексна сполука білка з Аргенту-мом), коларгол (колоїдне срібло) використовують для промивання сечовивідних шляхів, в очній практиці та дерматології як в'яжучі та антисептичні засоби.
Бактерицидні властивості Аргентуму використовують для знезараження питної води.
Аурум. Існує розділ медицини, який вивчає методи лікування препаратами Ауруму — хризотерапія. Біологічна роль Ауруму вивчена недостаньо. Ще у середньовіччі було відомо, що Аурум проявляє цілющі властивості при лікуванні прокази. Пізніше було встановлено, що ціаніди ауруму зменшують ріст туберкульозних паличок та інших патогенних організмів. У зв'язку з тим, що сполуки ауруму (ІII) є сильними окисниками, їх не використовують у сучасній хризотерапії. Похідні Аи(І) нестійкі у водних розчинах. Для їх стабілізації використовують комплекси, які містять сірковмісні та фосфоровмісні ліганди.Так, препарат кризаніл - (Au-S-CH2-CHOH-CH2SO3)2Ca застосовують для лікування кісткового туберкульозу. Усі сульфурвмісні препарати Ауруму проявляють лікарську дію при введенні внутрішньом'язово.
Фосфоровмісні препарати Ауруму менш токсичні, ніж тіолові комплекси ауруму(І). Вони виявилися активними протиартритними засобами. Оскільки ці сполуки добре всмоктуються у шлунку, їх можна застосовувати у вигляді таблеток.
Оскільки препарати Ауруму накопичуються у печінці та нирках, при наявності функціональних захворювань цих органів хризотерапія протипоказана.
