
- •Тема 7. Химическое равновесие
- •1. Для обратимой реакции
- •2. Для обратимой реакции
- •3. Для обратимой реакции
- •4. В обратимой реакции
- •5. В обратимой реакции
- •6. В состоянии равновесия обратимой реакции
- •7. В обратимой реакции
- •8. В обратимой реакции
- •9. При синтезе аммиака
- •10. В обратимой реакции
- •11. В обратимой реакции
- •12. В обратимой реакции
- •13. В обратимой реакции
- •14. В обратимой реакции
- •15. В обратимой реакции
- •16. Для обратимой реакции
- •17. В обратимой реакции
- •18. В обратимой реакции
- •19. Приведено уравнение обратимой реакции
- •20. Приведено уравнение обратимой реакции
- •21. Приведено уравнение обратимой реакции
- •22. Для обратимой реакции
- •23. Для обратимой реакции
- •24. Для обратимой реакции
- •25. Для обратимой реакции
- •26. Для обратимой реакции
- •27. Для обратимой реакции
- •28. Для обратимой реакции
- •29. Для обратимой реакции
- •30. Для обратимых реакций
- •31. Для обратимой реакции
- •38. Укажите реакции
- •39. Укажите, равновесие каких реакций
- •40. Для обратимой реакции
- •41. Для обратимой реакции
- •42. Укажите реакции
- •43. Для обратимой реакции
- •48. Для обратимой реакции
- •49. Для обратимой реакции
- •50. Укажите, равновесие каких реакций
- •Тема 8. Основы химической кинетики
- •V, моль/(л∙мин) 0,1 0,2 0,1
- •V, моль/(л∙мин) 9∙10–5 1,8∙10–4
- •V, моль/(л∙мин) 1∙10–4 2∙10–4
- •V, моль/(л∙мин) 3,34∙10–5 6,68∙10–5
- •V, моль/(л∙с) 2,5∙10–3 5,0∙10–3 4,5∙10–2
- •V, моль/(л∙мин) 0,2 0,4 0,3 1,2
- •V, моль/(л∙мин) 0,269 1,08 0,807
- •13. Скорость реакции термического разложения уксусного альдегида
- •V, моль/(л∙с) 1,8∙10–6 7,2∙10–6
- •33. Реакция омыления этилацетата в щелочной среде, протекающая по уравнению
- •42. При температуре 285 к некоторая реакция заканчивается за 3 ч, а при 305 к - за 45 мин. Вычислите
- •47. Константа скорости реакции гидролиза сахарозы (в слабокислом растворе) при температуре 20 °с равна 4,4∙10–6, а при 50 °с – 2,3∙10–4. Определите
- •48. Константа скорости реакции омыления этилацетата в щелочной среде
- •49. Скорость реакции разложения пероксида водорода в водном растворе
- •Тема 9. Способы выражения концентрации растворов
- •5. Установите соответствие между названием и обозначением способа выражения концентрации раствора:
- •Тема 10. Образование и свойства растворов неэлектролитов и электролитов
- •33. Установите соответствие между веществом и его свойством в водном растворе
- •34. Установите соответствие между веществом и его свойством в водном растворе
- •35. Установите соответствие между веществом и его свойством в водном растворе
- •Тема 11. Реакции в растворах электролитов
- •15. Установите соответствие между ионно-молекулярным и молекулярным уравнениями реакций:
- •16. Установите соответствие между ионно-молекулярным и молекулярным уравнениями реакций:
- •17. Установите соответствие между ионно-молекулярным и молекулярным уравнениями реакций:
- •25. Установите соответствие между веществом и средой его раствора:
- •26. Установите соответствие между веществом и средой его раствора:
- •27. Установите соответствие между веществом и средой его раствора:
- •28. Укажите ионы
- •29. Укажите соли
- •1) Кислота 2) вода 3) щелочь 4) карбонат натрия 5) хлорид калия
- •43. Установите соответствие между веществом, добавляемым к раствору хлорида железа (III), и его влиянием на гидролиз FeCl3:
- •44. Установите соответствие между веществом, которое добавляют к раствору хлорида цинка, и его влиянием на гидролиз ZnCl2:
- •45. Установите соответствие между веществом, которое добавляют к раствору сульфита калия, и его влиянием на гидролиз k2so3:
- •Тема 12. Электрохимические процессы
- •3. Укажите перечень
- •4. Расположите металлы
- •6. Укажите, как изменяется (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) электродный потенциал металлов в растворах их сульфатов
- •7. Укажите номер схемы гальванического элемента
- •8. Эдс гальванического элемента
- •11. Стандартный электродный потенциал цинка равен –0,76 b. Для концентрационного элемента
- •13. Приведены значения стандартных электродных потенциалов (в) металлов:
Тема 7. Химическое равновесие
1. Для обратимой реакции
2Ca(к) + CO2(г) D 2CaO(к) + C(к)
приведены математические выражения закона действующих масс:
1)
 2)
2)
 3)
3)
 4)
4)
 .
.
Укажите
правильное выражение закона действующих масс |
2 |
факторы, влияющие на константу равновесия (1 – концентрация веществ, 2 – катализатор, 3 – давление, 4 – температура) |
34 |
2. Для обратимой реакции
2NO(г) + O2(г) D 2NO2(г)
приведены математические выражения закона действующих масс
1)
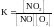 2)
2)
 3)
3)
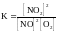 4)
4)
 .
.
Исходные концентрации оксида азота (II) и кислорода 0,02 и 0,01 моль/л соответственно, а равновесная концентрация оксида азота (IV) равна 0,015 моль/л. Определите
номер правильного выражения константы равновесия |
3 |
равновесную концентрацию кислорода |
0,0025 |
3. Для обратимой реакции
H2(г) + I2(г) D 2HI(г)
приведены математические выражения закона действующих масс
1)
 2)
2)
 3)
3)
 4)
4)
 .
.
Исходные концентрации водорода и йода равны 0,03 и 0,05 моль/л соответственно, равновесная концентрация йодоводорода 0,02 моль/л. Определите
номер правильного выражения константы равновесия |
4 |
равновесную концентрацию газообразного йода |
0,04 |
4. В обратимой реакции
2Pb(к) + О2(г) D 2PbO(к)
исходная концентрация O2 равна 5 моль/л; к моменту установления равновесия прореагировало 75 % этого вещества. Вычислите
равновесную концентрацию кислорода (моль/л) |
1,25 |
константу равновесия |
0,8 |
5. В обратимой реакции
Ni(к) + 4CO(г) D Ni(CO)4(г)
исходная концентрация оксида углерода (II) равна 10 моль/л; к моменту установления равновесия прореагировало 80 % СО. Вычислите
равновесную концентрацию СО (моль/л) |
2 |
константу равновесия |
0,125 |
6. В состоянии равновесия обратимой реакции
N2(г) + 3H2(г) D 2NH3(г)
концентрации азота, водорода и аммиака равны 3,2; 9,5 и 4 моль/л, соответственно. Вычислите
константу равновесия реакции |
0,0058 |
исходную концентрацию водорода (моль/л) |
15,5 |
7. В обратимой реакции
CO(г) + H2O(г) D СO2(г) + H2(г)
исходные концентрации оксида углерода (II) и паров воды одинаковы и равны 0,03 моль/л, равновесная концентрация CO2 равна 0,01 моль/л. Вычислите
константу равновесия |
0,25 |
равновесную концентрацию СО (моль/л) |
0,02 |
8. В обратимой реакции
N2(г) + O2(г) D 2NO(г)
равновесные концентрации газов равны (моль/л): [N2] = 0,03; [O2] = 0,06; [NO] = 0,02. Вычислите
константу равновесия реакции |
0,22 |
исходную концентрацию азота (моль/л) |
0,04 |
