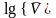- •Министерство образования и науки рф
- •Иркутский государственный технический университет физическая и коллоидная химия
- •260200 Производство продуктов питания
- •Иркутск 2012
- •Общие методические указания
- •Ниже приводится краткий консультативный материал в качестве помощника усвоения указанных тем Теплоемкость
- •Занятие 2.
- •2. Каталитические реакции
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем
- •Исходные данные
- •Математическая обработка экспериментальных данных. Интегрально-расчетный метод
- •Математическая обработка экспериментальных данных.
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •4. Агрегативная устойчивость
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •Лекции семестра №4 Лекция 1
- •Раздел 1. Химическая термодинамика.
- •Тема 1.1. Законы термодинамики (исп. Видеофильм и слайд-лекция)
- •Лекция 2 Первое начало термодинамики
- •Работа расширения идеального газа в различных процессах
- •Лекция 3 Термохимия
- •Теплоемкость
- •Приближенные методы расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Лекция 4
- •Стандартное состояние вещества
- •Лекция 4 второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Лекция 5 третье начало термодинамики
- •Термодинамические потенциалы
- •Лекция 6 химическое равновесие
- •Лекция 7
- •Лекция 8-10 фазовые равновесия (диаграммы двух и трёхкомпонентные на слайд-лекциях)
- •Лекция 11 Термодинамика растворов (слайд-лекции)
- •Образование растворов. Растворимость
- •Л екция 12 Растворимость твердых веществ в жидкостях
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17 электрохимические процессы
- •Лекция 18
- •Лекция 19 химическая кинетика
- •Лекция 20
- •Лекция 21
- •Лекция 22
- •Лекция 23
- •Лекция 24
- •Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
- •Лекция 26 Адсорбция
- •Лекция 27
- •Лекция 28
- •Лекция 29
- •Лекция 30
- •Лекция 31
- •Лекция 32
- •Лекция 33
- •Лекция 34
- •Лекция35
- •Формы контроля по дисциплине и оценка качества подготовки
- •Литература
Математическая обработка экспериментальных данных.
моль/л∙мин–1 |
∙103 моль/л |
|
|
2,857 2,077 1,453 1,000 0,600 0,320 |
13,70 12,15 9,90 7,45 4,90 1,90 |
-3,544 -3,683 -3,838 -4,000 -4,220 -4,500 |
-1,863 -1,915 -2,004 -2,13 -2,31 -2,72 |
Константу
скорости и порядок реакции найдем из
графика зависимости
 ,
представленного на рис. 4.
,
представленного на рис. 4.
Логарифмическая форма основного кинетического уравнения:
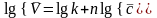 .
.
Здесь отрезок, отсекаемый прямой на оси ординат, равен: lgk = -1,51, откуда k = 0,0257 мин–1, а тангенс угла наклона линии к оси абсцисс связан с порядком реакции:
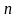
 =
=
 ≈1.
≈1.
Таким образом, задача, решенная четырьмя методами, показывает, что константа скорости реакции равна 0,026 мин–1, а реакция имеет первый порядок.
.3. Седиментационное равновесие
При изучении данной темы студент должен обратиться к учебникам:
[8], [9] раздел «Седиментация и Седиментационный анализ дисперсности» Далее, используя методическое пособие по поверхностным явлениям и дисперсным системам [14], рассмотреть и проработать теоретический раздел «Седиментационная устойчивость дисперсных систем»
Выполнить лабораторную работу №5 (часть II-я. См. теоретическое введение). Для этого следует использовать методические указания по химической кинетике [14].
Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
Кинетическая устойчивость золей. Седиментация
Частицы дисперсной фазы одновременно испытывают действие силы земного притяжения и архимедовой силы; в зависимости от соотношения плотностей дисперсионной среды и дисперсной фазы равнодействующая этих сил будет вынуждать частицы к оседанию либо всплытию. Процесс оседания либо всплытия коллоидных частиц в золе называется седиментацией. Однако седиментации всегда противодействует другой процесс, стремящийся к равномерному распределению коллоидных частиц по всему объему раствора – диффузия, осуществляемая под действием броуновского движения частиц. Соотношение между этими двумя процессами определяет кинетическую устойчивость золей – способность коллоидных частиц удерживаться во взвешенном состоянии, не подвергаясь седиментации.
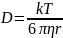 В
статистической теории броуновского
движения, развитой А.Эйнштейном, вводится
понятие средний сдвиг ±Δx,
представляющий собой проекцию расстояния
между положениями частицы X1
и X2,
в которых частица находилась во время
двух последовательных наблюдений через
время t.
Значение квадрата среднего сдвига можно
найти по уравнению Эйнштейна, связывающего
Δx2
с температурой T,
радиусом взвешенных частиц r
и вязкостью
среды η:
В
статистической теории броуновского
движения, развитой А.Эйнштейном, вводится
понятие средний сдвиг ±Δx,
представляющий собой проекцию расстояния
между положениями частицы X1
и X2,
в которых частица находилась во время
двух последовательных наблюдений через
время t.
Значение квадрата среднего сдвига можно
найти по уравнению Эйнштейна, связывающего
Δx2
с температурой T,
радиусом взвешенных частиц r
и вязкостью
среды η:
 (1)
(1)
Средний сдвиг частицы связан с коэффициентом диффузии D, который может быть рассчитан по уравнению (2):
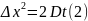

Как видно из уравнения (3), величина коэффициента диффузии определяется отношением тепловой энергии молекул kT и вязкостного сопротивления диффузии со стороны среды. Поскольку процесс диффузии проявляется тем сильнее, чем меньше масса частиц, кинетическая устойчивость золя прямо пропорциональна размеру коллоидных частиц. Заметное оседание частиц в системе, обладающей высокой кинетической устойчивостью, можно вызвать при помощи центрифугирования золя, используя значительные по величине центробежные силы, что многократно увеличивает силу, действующую на частицу и способствующую её оседанию (современные ультрацентрифуги работают при ускорениях свыше 400000g).
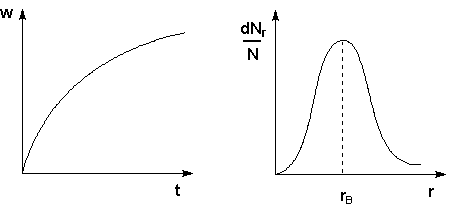
Рис. 1. Седиментационная кривая оседания частиц под действием силы тяжести
Рис. 2. Дифференциальная кривая распределения частиц по размерам
Методы седиментации и ультрацентрифугирования применяются для изучения полидисперсности коллоидных систем, обусловленной существованием в коллоидных системах частиц различных размеров. Изучение полидисперсности коллоидных систем для установления количественного распределения частиц по размерам (т.н. кривых распределения) – седиментационный анализ – производится при помощи измерения возрастания веса осевших частиц w со временем. По результатам такого исследования строят кривые седиментации (рис. 4.13). Проводя анализ кривой седиментации, можно рассчитать кривую распределения для данной системы, которая характеризует относительное содержание в системе частиц разного размера (рис. 4.14). Обычно кривые распределения содержат один максимум, который соответствует rв – наиболее вероятному радиусу частиц дисперсной фазы.
Основные закономерности и понятия
После изучения данной темы студент должен знать:
Что называется седиментацией;
Какие процессы способствуют, а какие препятствуют оседанию частиц в дисперсионной среде;
Условия седиментационного равновесия;
Седиментационный анализ дисперсности;
Что представляют собой кривые распределения частиц по размерам и правила их обработки;
По каким признакам определяют моно и полидисперсные системы.
Основные навыки
Студент должен уметь:
Определять и формулировать цель работы
Проводить анализ полученных результатов опытов и расчетов.
Сделать выводы на основании описательной части опытов наблюдений.
Анализировать кривые:
- седиментационную,
- интегральную и
- дифференциальную распределения частиц по размерам.
5. Сделать выводы на основании анализа кривых распределения.

 ∙104
∙104