
- •Министерство образования и науки рф
- •Иркутский государственный технический университет физическая и коллоидная химия
- •260200 Производство продуктов питания
- •Иркутск 2012
- •Общие методические указания
- •Ниже приводится краткий консультативный материал в качестве помощника усвоения указанных тем Теплоемкость
- •Занятие 2.
- •2. Каталитические реакции
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем
- •Исходные данные
- •Математическая обработка экспериментальных данных. Интегрально-расчетный метод
- •Математическая обработка экспериментальных данных.
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •4. Агрегативная устойчивость
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •Лекции семестра №4 Лекция 1
- •Раздел 1. Химическая термодинамика.
- •Тема 1.1. Законы термодинамики (исп. Видеофильм и слайд-лекция)
- •Лекция 2 Первое начало термодинамики
- •Работа расширения идеального газа в различных процессах
- •Лекция 3 Термохимия
- •Теплоемкость
- •Приближенные методы расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Лекция 4
- •Стандартное состояние вещества
- •Лекция 4 второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Лекция 5 третье начало термодинамики
- •Термодинамические потенциалы
- •Лекция 6 химическое равновесие
- •Лекция 7
- •Лекция 8-10 фазовые равновесия (диаграммы двух и трёхкомпонентные на слайд-лекциях)
- •Лекция 11 Термодинамика растворов (слайд-лекции)
- •Образование растворов. Растворимость
- •Л екция 12 Растворимость твердых веществ в жидкостях
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17 электрохимические процессы
- •Лекция 18
- •Лекция 19 химическая кинетика
- •Лекция 20
- •Лекция 21
- •Лекция 22
- •Лекция 23
- •Лекция 24
- •Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
- •Лекция 26 Адсорбция
- •Лекция 27
- •Лекция 28
- •Лекция 29
- •Лекция 30
- •Лекция 31
- •Лекция 32
- •Лекция 33
- •Лекция 34
- •Лекция35
- •Формы контроля по дисциплине и оценка качества подготовки
- •Литература
Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
На границе раздела различных фаз проявляются особенные свойства систем, которые называют поверхностными явлениями. К ним относятся, например, смачивание жидкостями поверхности твердых тел и адсорбция. Поверхностные явления имеют место на границе раздела твердое тело-газ (жидкость), жидкость-жидкость, жидкость-газ.
Причиной проявления поверхностных явлений оказывается избыточная энергия, сосредоточенная на границе раздела фаз. Рассмотрим взаимодействие молекул на границе жидкость-газ.
Характер взаимодействия молекул двух образующих систему компонентов влияет на энергию границы раздела. Молекулы жидкости в глубине фазы взаимодействуют друг с другом с одинаковой силой и результирующая сила равна нулю (f=0). Молекулы на границе раздела фаз взаимодействуют сильнее с одноимёнными молекулами со стороны жидкой фазы, нежели газообразной, поскольку их плотность в жидкости многократно превышает плотность в газовой фазе. Причем чем значительнее молекулы находятся в жидкой фазе, тем сильнее они втягиваются в нее (f ' > f " > f '"). Это приводит к нескомпенсированности сил взаимодействия частиц и возникновению избытка потенциальной энергии на поверхности жидкости. Эту энергию называют свободной поверхностной энергией, или энергией Гиббса поверхности GS. Энергия, отнесенная к единице площади поверхности, называется удельной поверхностной энергией, или поверхностным натяжением: σ = GS / s,
где s – площадь поверхности, м2.
Величина σ может выражаться двояко: Дж/м2 или Н/м. Это указывает на то, что поверхностное натяжение можно объяснить как с точки зрения энергетической, так и силовой трактовки.
С позиций термодинамики определяющими уравнениями для описания поверхностных явлений служат объединенные уравнения первого и второго законов термодинамики (иначе фундаментальные термодинамические уравнения) для открытых гетерогенных систем
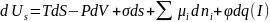
 (II)
(II)
Из уравнений (I) и (II) видно, что энергия σds может самопроизвольно превращаться в другие виды энергии: энергию Гиббса dG, теплоту SdT, объемно-механическую VdP, химическую μidni и электрическую φdq энергии. При этом будут иметь место различные явления: химическое взаимодействие веществ, электрические явления, адсорбция и прочее.
Из уравнения (II) найдем величину σ:

Соотношение (III) является термодинамическим определением σ: поверхностным натяжением называется частная производная энергии Гиббса по площади межфазной поверхности при постоянстве соответственных естественных переменных (Т, P, ni, q). Отсюда также следует выражение для энергии Гиббса поверхности GS = σ · s.
Возьмем объединенное уравнение первого и второго законов термодинамики для открытых гомогенных систем
из которого найдем химический потенциал


Сравнение уравнений (III) и (IV) показывает, что поверхностное натяжение σ (Дж/м2) означает для поверхности то же самое, что и химический потенциал компонента μi (Дж/моль) для объемной фазы. Аналогичные выражения можно записать с использованием внутренней энергии, энтальпии, энергии Гельмгольца.
Взаимодействие (сцепление) молекул, атомов, ионов внутри одной фазы называется когезией. Когезия обусловлена силами притяжения различной природы и определяет существование веществ в конденсированном состоянии. Работа когезии определяется затратой энергии на обратимый изотермический разрыв тела по сечению, равному единице площади. Так как при разрыве образуется две единицы площади, то работа когезии равна удвоенному значению поверхностного натяжения на границе с газом:
 .
.
Применительно
к идеальному твердому телу (отсутствие
дефектов структуры) величину
 часто называют прочностью на разрыв
(обратимый) или когезионной прочностью.
Реальные тела из-за наличия дефектов
структуры имеют значительно меньшую
(иногда в сто и тысячу раз) прочность.
часто называют прочностью на разрыв
(обратимый) или когезионной прочностью.
Реальные тела из-за наличия дефектов
структуры имеют значительно меньшую
(иногда в сто и тысячу раз) прочность.
Для жидкости и большинства твердых тел когезионные силы выражаются в межмолекулярном взаимодействии, обусловленном Ван-дер-ваальсовыми силами и водородными связями. Оно отличается от химического взаимодействия.
Поверхностные свойства тел непосредственно связаны с их объемными свойствами. Состав и структура твердых поверхностей зависит от условий их образования и последующей обработки.
Межфазное взаимодействие или взаимодействие между приведенными в контакт поверхностями конденсированных тел разной природы называется адгезией. Адгезия обеспечивает между двумя телами соединение определенной прочности, обусловленное межмолекулярными силами.
Различают
адгезию между двумя жидкостями, между
жидкостью и твердым телом и между двумя
твердыми телами. Работа адгезии
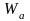 характеризует прочность адгезионной
связи, определяется работой обратимого
разрыва адгезионной связи, отнесенной
к единице площади. Адгезия – результат
стремления системы к уменьшению
поверхностной энергии, поэтому она
является самопроизвольным процессом.
характеризует прочность адгезионной
связи, определяется работой обратимого
разрыва адгезионной связи, отнесенной
к единице площади. Адгезия – результат
стремления системы к уменьшению
поверхностной энергии, поэтому она
является самопроизвольным процессом.
Как и адгезия, смачивание и растекание относятся к межфазным взаимодействия. Смачивание и растекание предполагают наличие хотя бы одной из фаз в жидком состоянии и обусловлены адгезионным взаимодействием.
Адгезия и смачивание сопровождают друг друга и соответствующим образом характеризуют межфазное взаимодействие.
Явления адгезии и смачивания широко распространены в природе и в различных отраслях народного хозяйства: склеивание материалов, нанесение лакокрасочных и неорганических покрытий, получение материалов на основе связующих и наполнителей (бетон, резина, стеклопластики и т.п.), сварка и паяние металлов, печатание, крашение, флотация и др.
Соотношение
между работой адгезии и поверхностным
натяжением определяет уравнение Дюпре:
 ,
в котором
,
в котором
 и
и
 - поверхностные натяжения контактирующих
тел на границе с воздухом;
- поверхностные натяжения контактирующих
тел на границе с воздухом;
 - межфазное натяжение на границе тел.
- межфазное натяжение на границе тел.
Работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше межфазное натяжение. В то же время, чем больше работа адгезии, тем меньше межфазное натяжение. Эти выводы имеют большое практическое значение.
В зависимости от природы взаимодействующих тел и условий, при которых происходит процесс, различают несколько механизмов адгезии: механическая адгезия; молекулярная; электрическая; диффузионная.
Теоретическая оценка адгезии еще очень приближенна, это связано с несовершенством имеющихся уравнений и рядом других причин.
Капля жидкости может растекаться по поверхности или собираться в каплю, её форма определяется уравнением Юнга:

В
уравнении рассматривается три различные
поверхности раздела фаз: твердое тело
– жидкость; твердое тело – газ и
жидкость-газ. Отличие смачивания и
растекания от адгезии состоит в
присутствии трех
сопряженных фаз. Угол
 между поверхностями жидкость-газ и
жидкость-твердое тело называется краевым
углом смачивания, в зависимости от
значения
различают условия:
между поверхностями жидкость-газ и
жидкость-твердое тело называется краевым
углом смачивания, в зависимости от
значения
различают условия:
1. краевой угол острый 0° < < 90°; поверхность считают хорошо смачиваемой и называют лиофильной (гидрофильной). При этом происходит растекание жидкости.
2. краевой угол тупой 180° > > 90°; поверхность несмачивается и называется лиофобной (гидрофобной).
3.
условие
= 90° и
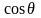 = 0 определяет границу между смачиваемостью
и несмачиваемостью (инверсия смачиваемости,
граница между лиофильностью и
лиофобностью).
= 0 определяет границу между смачиваемостью
и несмачиваемостью (инверсия смачиваемости,
граница между лиофильностью и
лиофобностью).
Гидрофильную поверхность имеют оксиды и гидроксиды металлов, силикаты, сульфаты, карбонаты. Они относятся к высокоэнергетическим поверхностям (> 100 мДж/м2). Гидрофобную поверхность имеют металлы и сульфиды металлов, материалы из органических соединений с большим содержанием углеводородных групп (парафин, стеарин, фторопласт, полиамиды, поливинилхлориды и др.). Они относятся к низкоэнергетическим поверхностям (< 100 мДж/м2).
Краевой угол удобно измерять с помощью довольно простой установки, принцип действия которой состоит в проектировании капли на экран и измерении краевого угла на проекции. Большая чувствительность краевого угла смачивания к загрязнениям часто используется для определения чистоты поверхности.
Работа адгезии связана с краевым углом смачивания уравнением Дюпре-Юнга:

Для увеличения смачивания надо увеличивать работу адгезии, это достигается введением ПАВ, изменением температуры. Различные жидкость по-разному смачивают одну и ту же поверхность. Лучше смачивает поверхность та жидкость, которая имеет меньшее поверхностное натяжение. Органические жидкости характеризуются низкими поверхностными натяжениями и поэтому смачивают большинство поверхностей разной природы. Например, углеводороды, у которых поверхностное натяжение 18-28 мДж/м2, смачивают все известные твердые тела.
Для реальных тел большое значение имеет микрорельеф поверхности твердого тела.
Одна и та же жидкость по-разному смачивает разные поверхности. Процесс превращения несмачиваемой поверхности в смачиваемую называется гидрофилизацией, а обратные процесс перехода смачиваемой поверхности в несмачиваемую – гидрофобизацией. Управление смачиванием основано на модификации (изменении) поверхности путем создания на нем адсорбционного слоя ПАВ. Выбор условий для адсорбции и ориентации ПАВ на границе раздела т-ж определяется правилом Ребиндера. Возможность предвидеть явления смачивания и управлять ими составляет научную основу многих производственных процессов, в том числе флотации – метода обогащения полезных ископаемых.
