
- •Министерство образования и науки рф
- •Иркутский государственный технический университет физическая и коллоидная химия
- •260200 Производство продуктов питания
- •Иркутск 2012
- •Общие методические указания
- •Ниже приводится краткий консультативный материал в качестве помощника усвоения указанных тем Теплоемкость
- •Занятие 2.
- •2. Каталитические реакции
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем
- •Исходные данные
- •Математическая обработка экспериментальных данных. Интегрально-расчетный метод
- •Математическая обработка экспериментальных данных.
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •4. Агрегативная устойчивость
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •Лекции семестра №4 Лекция 1
- •Раздел 1. Химическая термодинамика.
- •Тема 1.1. Законы термодинамики (исп. Видеофильм и слайд-лекция)
- •Лекция 2 Первое начало термодинамики
- •Работа расширения идеального газа в различных процессах
- •Лекция 3 Термохимия
- •Теплоемкость
- •Приближенные методы расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Лекция 4
- •Стандартное состояние вещества
- •Лекция 4 второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Лекция 5 третье начало термодинамики
- •Термодинамические потенциалы
- •Лекция 6 химическое равновесие
- •Лекция 7
- •Лекция 8-10 фазовые равновесия (диаграммы двух и трёхкомпонентные на слайд-лекциях)
- •Лекция 11 Термодинамика растворов (слайд-лекции)
- •Образование растворов. Растворимость
- •Л екция 12 Растворимость твердых веществ в жидкостях
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17 электрохимические процессы
- •Лекция 18
- •Лекция 19 химическая кинетика
- •Лекция 20
- •Лекция 21
- •Лекция 22
- •Лекция 23
- •Лекция 24
- •Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
- •Лекция 26 Адсорбция
- •Лекция 27
- •Лекция 28
- •Лекция 29
- •Лекция 30
- •Лекция 31
- •Лекция 32
- •Лекция 33
- •Лекция 34
- •Лекция35
- •Формы контроля по дисциплине и оценка качества подготовки
- •Литература
Лекция 13
Перегонка двойных жидких растворов 1-го типа
Рассмотрим диаграммы состояния бинарного жидкого раствора, летучие компоненты которого неограниченно растворимы друг в друге и не образуют азеотропную смесь (системы 1-го типа).
Для построения диаграммы состояния на одном графике откладываются две зависимости: зависимость давления насыщенного пара от состава раствора и зависимость давления насыщенного пара от состава пара (рис. 3.7) или зависимость температуры кипения раствора от состава раствора и зависимость температуры кипения раствора от состава равновесного пара (рис.3.8)
Рассмотрим диаграмму состояния, изображённую на рис. 3.7. Кривая KLMN представляет собой зависимость давления насыщенного пара от состава раствора; над кривой находится область, отвечающая жидкой фазе. Кривая KRQN представляет собой зависимость давления насыщенного пара от состава пара; под кривой находится область, отвечающая газообразной фазе. Область между кривыми – область гетерогенности системы. Как видно из диаграммы, раствору состава ХВ отвечает равновесный пар состава YB (точки L и R), давление которого равно Р1, а раствору состава Х'В – равновесный пар состава Y'B (точки M и Q) давление которого равно Р2. Таким образом, увеличение концентрации компонента В приводит к уменьшению общего давления пара, и в соответствии с 1-м законом Коновалова равновесный пар содержит больше компонента А, чем раствор.
При рассмотрении процесса перегонки жидкости при постоянном давлении используется диаграмма состояния в координатах температура кипения – состав, изображённая на рис. 3.8.
Рис. 3.8. Диаграмма состояния системы 1-го типа в координатах температура – состав (P = const)
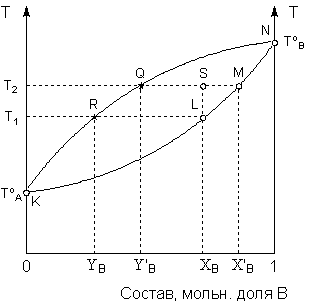
Кривая KLMN представляет собой зависимость температуры кипения от состава раствора; под кривой находится область, отвечающая жидкой фазе. Кривая KRQN представляет собой зависимость температуры кипения раствора от состава пара; над кривой находится область, отвечающая газообразной фазе. Область между кривыми – область гетерогенности системы.
К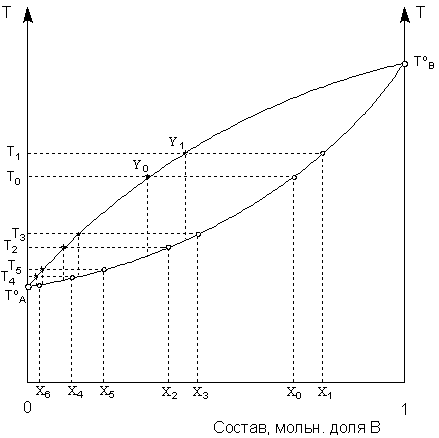 ак
видно из диаграммы, раствор состава ХВ
имеет
температуру кипения Т1
(точка
L),
а находящийся с ним в равновесии пар –
состав YB
(точка R),
т.е. обогащён компонентом A,
добавление которого к раствору понижает
температуру кипения раствора. Диаграмма
состояния позволяет не только определить
состав равновесных фаз, но и рассчитать
их относительные количества. Рассмотрим
систему общего состава ХВ,
находящуюся при температуре Т2
(точка S).
Равновесная жидкая фаза (точка M)
будет иметь состав Х'В,
а равновесный пар – состав Y'В
(точка Q).
Относительные количества фаз определяются
по правилу рычага; в данном случае
количество жидкой фазы (в молях, поскольку
состав выражен в мольных долях) будет
относиться к количеству пара, как длина
отрезка |QS|
относится к длине отрезка |SM|.
ак
видно из диаграммы, раствор состава ХВ
имеет
температуру кипения Т1
(точка
L),
а находящийся с ним в равновесии пар –
состав YB
(точка R),
т.е. обогащён компонентом A,
добавление которого к раствору понижает
температуру кипения раствора. Диаграмма
состояния позволяет не только определить
состав равновесных фаз, но и рассчитать
их относительные количества. Рассмотрим
систему общего состава ХВ,
находящуюся при температуре Т2
(точка S).
Равновесная жидкая фаза (точка M)
будет иметь состав Х'В,
а равновесный пар – состав Y'В
(точка Q).
Относительные количества фаз определяются
по правилу рычага; в данном случае
количество жидкой фазы (в молях, поскольку
состав выражен в мольных долях) будет
относиться к количеству пара, как длина
отрезка |QS|
относится к длине отрезка |SM|.
Т
Рис. 3.9. Ректификация смеси
летучих жидкостей.
аким образом, диаграмма состояния позволяет определить состав фракции, отгоняющейся из раствора состава ХВ в интервале температур от Т1 до Т2. Очевидно, что в этом случае состав фракции будет находиться между YВ и Y'В, т.е. отогнанная фракция будет обогащена по сравнению с исходным раствором компонентом A. Если сконденсированный пар подвергнуть повторной перегонке, будет получена фракция, ещё более обогащённая компонентом A. В результате многократного повторения таких операций может быть получен пар чистого компонента A. Разделение компонентов жидкого раствора, имеющих различные температуры кипения, за счёт многократного повторения циклов испарение – конденсация называется ректификацией. Схематически процесс ректификации показан на рис. 3.9.При перегонке исходного раствора состава Хo состав раствора непрерывно изменяется, и температура кипения повышается. При перегонке в интервале температур от Тo до Т1 состав равновесного пара также изменяется от Yo до Y1; его конденсацией будет получена жидкая фракция состава Х2, кипящая при температуре Т2. Перегонкой её в интервале температур от Т2 до Т3 после конденсации пара будет получена фракция состава Х4, кипящая при температуре Т4. Перегоняя последнюю в интервале температур от Т4 до Т5, получают фракцию состава Х6. Состав и температура кипения данной фракции уже довольно близки к чистому компоненту A. Количество необходимых для полного разделения компонентов раствора циклов испарение – конденсация (т.н. число теоретических тарелок ректификационной колонны) определяется природой компонентов (прежде всего разностью их температур кипения) и желаемой степенью чистоты получаемого ректификата и может быть рассчитано с помощью диаграммы состояния системы.
Перегонка двойных жидких растворов 2-го типа
В случае если зависимость общего давления насыщенного пара смеси летучих компонентов имеет экстремум (т.н. смеси 2-го типа), диаграммы состояния системы раствор – пар имеют вид, показанный на рисунках 3.10 – 3.11.
Температура кипения азеотропных растворов при постоянном внешнем давлении неизменна, и состав раствора при перегонке не изменяется (как у индивидуальных веществ). Диаграмму состояния системы 2-го типа в принципе можно рассматривать как совокупность диаграмм состояния двух систем первого типа, в каждой из которых в качестве одного из компонентов выступает азеотропная смесь.
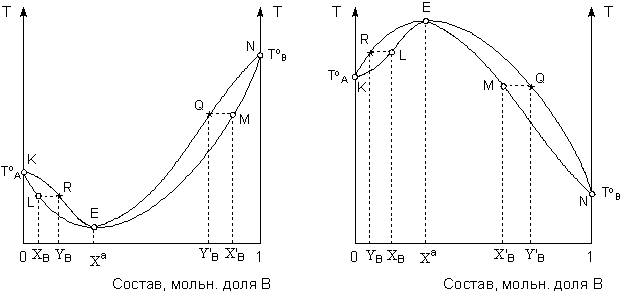
Рис. 3.10 Диаграммы состояния раствор – пар для летучих смесей 2-го типа в координатах давление насыщенного пара – состав для систем с максимумом (А) и минимумом (Б) общего давления
А
Б
Б
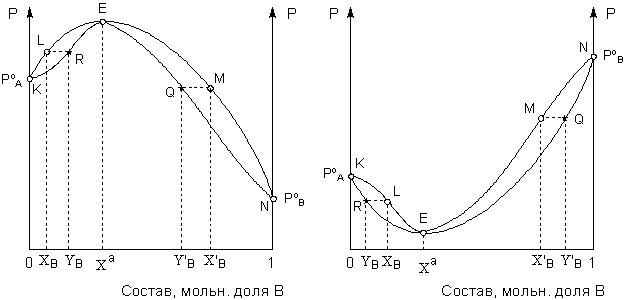
Рис. 3.11. Диаграммы состояния раствор – пар для летучих смесей 2-го типа в координатах температура кипения – состав для систем с минимумом (А) и максимумом (Б) температуры кипения.
А
Анализ диаграммы состояния таких систем аналогичен таковому для систем 1-го типа. Как видно из рисунка 3.11, полное разделение подобных систем перегонкой невозможно. При фракционной перегонке системы с минимумом температуры кипения (рис. 3.11-А) состав дистиллята постепенно приближается к азеотропному. Кубовой остаток при этом обогащается тем компонентом, который в исходном растворе находился в избытке по сравнению с составом азеотропной смеси – компонентом А в области концентраций левее азеотропной точки и компонентом B в области концентраций правее азеотропной точки. В системах с максимумом температуры кипения (рис. 3.11-В), напротив, дистиллят обогащается компонентом, который находился в избытке по отношению к азеотропному раствору, а состав кубового остатка постепенно приближается к азеотропному.
Следует, однако, помнить, что отождествление азеотропной смеси с индивидуальным веществом является сугубо условным. При изменении внешнего давления происходит смещение экстремума на кривой зависимости температуры кипения от состава (в некоторых случаях может произойти исчезновение экстремума). Следовательно, составы азеотропных растворов для жидких смесей данных компонентов при разных давлениях различаются. Так, для системы этанол – вода мольная доля этанола в азеотропе составляет 0.895 при давлении, равном 760 мм рт. ст., и 0,996 – при 100 мм рт. ст.
