
- •Министерство образования и науки рф
- •Иркутский государственный технический университет физическая и коллоидная химия
- •260200 Производство продуктов питания
- •Иркутск 2012
- •Общие методические указания
- •Ниже приводится краткий консультативный материал в качестве помощника усвоения указанных тем Теплоемкость
- •Занятие 2.
- •2. Каталитические реакции
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем
- •Исходные данные
- •Математическая обработка экспериментальных данных. Интегрально-расчетный метод
- •Математическая обработка экспериментальных данных.
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •4. Агрегативная устойчивость
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •Лекции семестра №4 Лекция 1
- •Раздел 1. Химическая термодинамика.
- •Тема 1.1. Законы термодинамики (исп. Видеофильм и слайд-лекция)
- •Лекция 2 Первое начало термодинамики
- •Работа расширения идеального газа в различных процессах
- •Лекция 3 Термохимия
- •Теплоемкость
- •Приближенные методы расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Лекция 4
- •Стандартное состояние вещества
- •Лекция 4 второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Лекция 5 третье начало термодинамики
- •Термодинамические потенциалы
- •Лекция 6 химическое равновесие
- •Лекция 7
- •Лекция 8-10 фазовые равновесия (диаграммы двух и трёхкомпонентные на слайд-лекциях)
- •Лекция 11 Термодинамика растворов (слайд-лекции)
- •Образование растворов. Растворимость
- •Л екция 12 Растворимость твердых веществ в жидкостях
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17 электрохимические процессы
- •Лекция 18
- •Лекция 19 химическая кинетика
- •Лекция 20
- •Лекция 21
- •Лекция 22
- •Лекция 23
- •Лекция 24
- •Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
- •Лекция 26 Адсорбция
- •Лекция 27
- •Лекция 28
- •Лекция 29
- •Лекция 30
- •Лекция 31
- •Лекция 32
- •Лекция 33
- •Лекция 34
- •Лекция35
- •Формы контроля по дисциплине и оценка качества подготовки
- •Литература
Л екция 12 Растворимость твердых веществ в жидкостях
Р
Рис. 3.2 Кривые растворимости некоторых солей в воде:
1 – КNО3, 2 – Nа2SО4·10Н2О, 3 – Nа2SО4,
4 – Ва(NО3)2
астворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры; сведения о растворимости твердых тел целиком основаны на опытных данных. Качественным обобщением экспериментальных данных по растворимости является принцип "подобное в подобном": полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот. Зависимость растворимости S от температуры обычно изображают графически в виде кривых растворимости (рис. 3.2).Поскольку теплота растворения твердых веществ в жидкостях может быть как положительной, так и отрицательной, растворимость при увеличении температуры может увеличиваться либо уменьшаться (согласно принципу Ле Шателье – Брауна).
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
Давление насыщенного пара разбавленных растворов
Пусть в равновесную систему жидкость А – пар введено некоторое вещество В. При образовании раствора мольная доля растворителя XА становится меньше единицы; равновесие в соответствии с принципом Ле Шателье – Брауна смещается в сторону конденсации вещества А, т.е. в сторону уменьшения давления насыщенного пара РА. Т.о., чем меньше мольная доля компонента А в растворе, тем меньше парциальное давление его насыщенных паров над раствором. Для некоторых растворов выполняется следующая закономерность, называемая первым законом Рауля:
 (10)
(10)
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:

Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
Растворы, для которых выполняется закон Рауля, называют идеальными растворами. Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций.
Д авление
пара идеальных и реальных растворов
авление
пара идеальных и реальных растворов
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание компонентов в парах будет, как правило, отличаться от содержания их в растворе – пар относительно богаче компонентом, температура кипения которого ниже). Рассмотрим бинарный раствор, состоящий из компонентов А и В, неограниченно растворимых друг в друге. Общее давление пара, согласно первому закону Рауля, равно

Рис. 3.3 Зависимость парциальных и общего давлений пара идеального раствора от концентрации
Таким образом, для идеальных бинарных растворов зависимость общего и парциального давления насыщенного пара от состава раствора, выраженного в мольных долях компонента В, является линейной при любых концентрациях (рис.3.3).
К таким системам относятся, например, системы бензол – толуол, гексан – гептан, смеси изомерных углеводородов и др.
Для реальных растворов данные зависимости являются криволинейными. Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения). Реальные растворы с положительными отклонениями давления пара образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0), растворы с отрицательными отклонениями образуются с выделением теплоты (ΔНраств < 0).
Состав равновесного пара над раствором

Если рассмотреть, как соотносятся состав раствора и состав равновесного пара, то нетрудно показать, что в общем случае мольная доля компонента в растворе Хi не совпадает с мольной долей компонента в паре Yi.

Подставив сюда уравнение (9), получаем:

Разделив
числитель и знаменатель правой части
уравнения на Р°А
и введя обозначение
 ,
получим:
,
получим:
 Из
уравнения (15) видно, что YB
= XB
только при условии, что α
= 1, т.е. при равенстве давлений насыщенного
пара чистых компонентов А
и В.
Если α
>
1,
то мольная доля компонента В
в паре оказывается больше, чем его
мольная доля в растворе (и наоборот).
Из
уравнения (15) видно, что YB
= XB
только при условии, что α
= 1, т.е. при равенстве давлений насыщенного
пара чистых компонентов А
и В.
Если α
>
1,
то мольная доля компонента В
в паре оказывается больше, чем его
мольная доля в растворе (и наоборот).
В
Рис. 3.5 Зависимость состава пара от состава раствора для идеальных растворов.
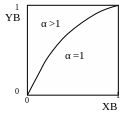 ид
зависимости состава равновесного пара
от состава раствора приведён на рис.
3.5
ид
зависимости состава равновесного пара
от состава раствора приведён на рис.
3.5
Данную зависимость состава пара от состава раствора качественно описывает первый закон Коновалова:
Равновесный пар по сравнению с жидкостью относительно обогащён тем компонентом, добавление которого к жидкости повышает общее давление пара над раствором (или, что то же самое, понижает температуру кипения раствора при некотором постоянном давлении).
П
Рис. 3.6. Зависимость состава пара от состава раствора для систем, имеющих экстремум на кривой зависимости общего давления пара от состава раствора.
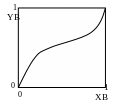 ервый
закон Коновалова применим как к идеальным,
так и к неидеальным растворам. Если
отклонения от первого закона Рауля
невелики, то зависимость состава пара
от состава раствора имеет вид, аналогичный
изображённому на рис. 3.5 для случая,
когда α
> 1.
Если отклонения раствора от идеального
велики, на кривой зависимости общего
давления пара от состава раствора может
появиться экстремум (максимум или
минимум для положительных и отрицательных
отклонений соответственно). В этом
случае зависимость состава пара от
состава раствора имеет более сложный
вид, показанный на рис. 3.6.
ервый
закон Коновалова применим как к идеальным,
так и к неидеальным растворам. Если
отклонения от первого закона Рауля
невелики, то зависимость состава пара
от состава раствора имеет вид, аналогичный
изображённому на рис. 3.5 для случая,
когда α
> 1.
Если отклонения раствора от идеального
велики, на кривой зависимости общего
давления пара от состава раствора может
появиться экстремум (максимум или
минимум для положительных и отрицательных
отклонений соответственно). В этом
случае зависимость состава пара от
состава раствора имеет более сложный
вид, показанный на рис. 3.6.
Аналогичная ситуация может иметь место и для близких к идеальному раствору систем, в которых компоненты раствора имеют близкие температуры кипения (давления насыщенного пара над чистым компонентом). Данная ситуация описывается вторым законом Коновалова:
Точки экстремума на кривой зависимости общего давления пара от состава раствора отвечают растворам, состав равновесного пара над которыми совпадает с составом раствора.
Такие растворы называются нераздельно кипящими или азеотропными смесями.
Законы Коновалова можно вывести термодинамически, воспользовавшись уравнением Дюгема – Моргулиса, связывающим парциальные давления паров компонентов бинарного раствора с их мольными долями в растворе:

Переписав уравнение (16) в виде

и подставив туда XA = 1 – XB, получаем:

Выражая dPA из уравнения (18) и подставляя вместо парциального давления каждого из компонентов произведение общего давления пара на мольную долю компонента в паре (PA = PYA = P(1–YB), PB = PYB), получим:
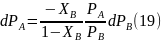
Учитывая, что, согласно закону Дальтона, dP = dPA + dPB, уравнение (19) можно переписать относительно dP:

Разделив это выражение на dXB, получаем зависимость, связывающую общее давление пара над бинарным раствором с мольной долей компонента B в растворе:
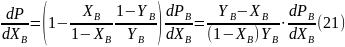
Таким
образом, если добавление в раствор
компонента B
увеличивает общее давление пара
 ,
то, поскольку производная
,
то, поскольку производная 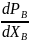 всегда положительна, получаем, что
YB – XB > 0,
доказав 1-й закон Коновалова.
всегда положительна, получаем, что
YB – XB > 0,
доказав 1-й закон Коновалова.
В
точке экстремума производная давления
по мольной доле B
 равна
нулю. Отсюда получаем:
равна
нулю. Отсюда получаем:
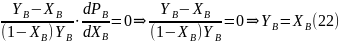
На различии составов раствора и равновесного с ним пара основано разделение растворов с помощью перегонки. Для рассмотрения равновесия в таких системах удобно пользоваться диаграммами состояния раствор – пар в координатах давление пара – состав или температура кипения – состав.
