
- •Министерство образования и науки рф
- •Иркутский государственный технический университет физическая и коллоидная химия
- •260200 Производство продуктов питания
- •Иркутск 2012
- •Общие методические указания
- •Ниже приводится краткий консультативный материал в качестве помощника усвоения указанных тем Теплоемкость
- •Занятие 2.
- •2. Каталитические реакции
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем
- •Исходные данные
- •Математическая обработка экспериментальных данных. Интегрально-расчетный метод
- •Математическая обработка экспериментальных данных.
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •4. Агрегативная устойчивость
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •Лекции семестра №4 Лекция 1
- •Раздел 1. Химическая термодинамика.
- •Тема 1.1. Законы термодинамики (исп. Видеофильм и слайд-лекция)
- •Лекция 2 Первое начало термодинамики
- •Работа расширения идеального газа в различных процессах
- •Лекция 3 Термохимия
- •Теплоемкость
- •Приближенные методы расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Лекция 4
- •Стандартное состояние вещества
- •Лекция 4 второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Лекция 5 третье начало термодинамики
- •Термодинамические потенциалы
- •Лекция 6 химическое равновесие
- •Лекция 7
- •Лекция 8-10 фазовые равновесия (диаграммы двух и трёхкомпонентные на слайд-лекциях)
- •Лекция 11 Термодинамика растворов (слайд-лекции)
- •Образование растворов. Растворимость
- •Л екция 12 Растворимость твердых веществ в жидкостях
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17 электрохимические процессы
- •Лекция 18
- •Лекция 19 химическая кинетика
- •Лекция 20
- •Лекция 21
- •Лекция 22
- •Лекция 23
- •Лекция 24
- •Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
- •Лекция 26 Адсорбция
- •Лекция 27
- •Лекция 28
- •Лекция 29
- •Лекция 30
- •Лекция 31
- •Лекция 32
- •Лекция 33
- •Лекция 34
- •Лекция35
- •Формы контроля по дисциплине и оценка качества подготовки
- •Литература
Термодинамические потенциалы
Изменение энтропии определяет направление процесса лишь в изолированных системах. Однако на практике больший интерес вызывают системы, обменивающиеся с окружающей средой энергией (закрытые системы). Поэтому, для характеристики этих процессов были введены термодинамические функции – свободная энергия Гельмгольца (изохорно-изотермический потенциал) и свободная энергия Гиббса (изобарно-изотермический потенциал). Для сокращенного названия принято определение: энергия Гельмгольца (F, Дж, кДж, Дж/моль, кДж/моль) и энергия Гиббса (G, Дж, кДж, Дж/моль, кДж/моль).
«Поведение» термодинамической системы характеризуют энтальпийный и энтропийный факторы. Энтальпийный фактор отражает стремление системы к минимуму «тепловой энергии»; энтропийный – отражает стремление системы к максимальной неупорядоченности. Например, для изолированных систем (при ΔН = 0) критерий направленности самопроизвольного процесса, а также предел его протекания определяется величиной изменения энтропии (ΔS). Если система находится при температурах, близких к абсолютному нулю, то критерием направленности является изменение энтальпии, т.к. в этом случае энтропия не изменяется или равна нулю.
Для закрытых систем при температурах, не равных нулю, при определении направленности процесса, необходимо учитывать оба фактора. Поэтому в любых системах направление и предел протекания самопроизвольного процесса определяет более общий принцип минимума свободной энергии:
Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения.
Для закрытых систем, находящихся в изобарно-изотермических либо изохорно-изотермических условиях свободная энергия принимает вид изобарно-изотермического либо изохорно-изотермического потенциалов (т.н. свободная энергия Гиббса и Гельмгольца соответственно). Данные функции называют иногда просто термодинамическими потенциалами, что не вполне строго, поскольку термодинамическими потенциалами являются также внутренняя энергия (изохорно-изоэнтропийный) и энтальпия (изобарно-изоэнтропийный потенциал).
Рассмотрим закрытую систему, в которой осуществляется равновесный процесс при постоянных температуре и объеме (V, T = const). Выразим работу данного процесса, которую обозначим Amax (поскольку работа процесса, проводимого равновесно, максимальна), из уравнений (53, 54).
Запишем
уравнение первого начала термодинамики
для дифференциально малого количества
теплоты
 Из второго
начала
Из второго
начала
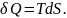
Подставим TdS в уравнение первого начала и решим его относительно δА:
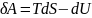 (68)
(68)
или после интегрирования от S1 до S2 и от U1 до U2:
 (69)
(69)
Преобразуем выражение (69), сгруппировав члены с одинаковыми индексами:
 (70)
(70)
Введя обозначение:
 (71)
(71)
получаем:
 (72)
(72)
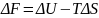 (73)
(73)
Функция есть изохорно-изотермический потенциал (свободная энергия Гельмгольца), определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях.
Закрытую систему, находящуюся в изобарно-изотермических условиях, характеризует изобарно-изотермический потенциал G:
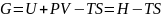 (74)
(74)
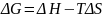 (75)
(75)
Поскольку –ΔF = Amax, можно записать:
 (76)
(76)
Величину А'max называют максимальной полезной работой (максимальная работа за вычетом работы расширения). Основываясь на принципе минимума свободной энергии, можно сформулировать условия самопроизвольного протекания процесса в закрытых системах.
Условия самопроизвольного протекания процессов в закрытых системах:
Изобарно-изотермические (P = const, T = const):
ΔG < 0, dG < 0
Изохорно-изотермические (V = const, T = const):
ΔF < 0, dF < 0
Процессы, которые сопровождаются увеличением термодинамических потенциалов, протекают лишь при совершении работы извне над системой. В химии наиболее часто используется изобарно-изотермический потенциал, поскольку большинство химических (и биологических) процессов происходят при постоянном давлении. Для химических процессов величину ΔG можно рассчитать, зная ΔH и ΔS процесса, по уравнению (75), либо пользуясь таблицами стандартных термодинамических потенциалов образования веществ ΔG°обр; в этом случае ΔG° реакции рассчитывается аналогично ΔН° по уравнению (77):
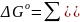 (77)
(77)
Величина
стандартного изменения изобарно-изотермического
потенциала в ходе химической любой
реакции
 есть мера химического сродства исходных
веществ. Основываясь на уравнении (75),
можно оценить вклад энтальпийного и
энтропийного факторов в величину ΔG
и сделать некоторые обобщающие заключения
о возможности самопроизвольного
протекания химических процессов,
основываясь на знаке величин ΔН
и ΔS.
есть мера химического сродства исходных
веществ. Основываясь на уравнении (75),
можно оценить вклад энтальпийного и
энтропийного факторов в величину ΔG
и сделать некоторые обобщающие заключения
о возможности самопроизвольного
протекания химических процессов,
основываясь на знаке величин ΔН
и ΔS.
1. Экзотермические реакции; ΔH < 0.
а) Если ΔS > 0, то ΔG всегда отрицательно; экзотермические реакции, сопровождающиеся увеличением энтропии, всегда протекают самопроизвольно.
б) Если ΔS < 0, реакция будет идти самопроизвольно при ΔН > TΔS (низкие температуры).
2. Эндотермические реакции; ΔH > 0.
а) Если ΔS > 0, процесс будет самопроизвольным при ΔН < TΔS (высокие температуры).
б) Если ΔS < 0, то ΔG всегда положительно; самопроизвольное протекание эндотермических реакций, сопровождающихся уменьшением энтропии, невозможно.
