
- •Министерство образования и науки рф
- •Иркутский государственный технический университет физическая и коллоидная химия
- •260200 Производство продуктов питания
- •Иркутск 2012
- •Общие методические указания
- •Ниже приводится краткий консультативный материал в качестве помощника усвоения указанных тем Теплоемкость
- •Занятие 2.
- •2. Каталитические реакции
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем
- •Исходные данные
- •Математическая обработка экспериментальных данных. Интегрально-расчетный метод
- •Математическая обработка экспериментальных данных.
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •4. Агрегативная устойчивость
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •Лекции семестра №4 Лекция 1
- •Раздел 1. Химическая термодинамика.
- •Тема 1.1. Законы термодинамики (исп. Видеофильм и слайд-лекция)
- •Лекция 2 Первое начало термодинамики
- •Работа расширения идеального газа в различных процессах
- •Лекция 3 Термохимия
- •Теплоемкость
- •Приближенные методы расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Лекция 4
- •Стандартное состояние вещества
- •Лекция 4 второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Лекция 5 третье начало термодинамики
- •Термодинамические потенциалы
- •Лекция 6 химическое равновесие
- •Лекция 7
- •Лекция 8-10 фазовые равновесия (диаграммы двух и трёхкомпонентные на слайд-лекциях)
- •Лекция 11 Термодинамика растворов (слайд-лекции)
- •Образование растворов. Растворимость
- •Л екция 12 Растворимость твердых веществ в жидкостях
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17 электрохимические процессы
- •Лекция 18
- •Лекция 19 химическая кинетика
- •Лекция 20
- •Лекция 21
- •Лекция 22
- •Лекция 23
- •Лекция 24
- •Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
- •Лекция 26 Адсорбция
- •Лекция 27
- •Лекция 28
- •Лекция 29
- •Лекция 30
- •Лекция 31
- •Лекция 32
- •Лекция 33
- •Лекция 34
- •Лекция35
- •Формы контроля по дисциплине и оценка качества подготовки
- •Литература
Лекция 4
Зависимость теплового эффекта реакции от температуры.
Закон Кирхгоффа
В общем случае тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на ΔН и ΔU реакции обычно пренебрегают. Влияние температуры на величины тепловых эффектов описывает закон Кирхгоффа:
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции.
Продифференцируем
ΔН
и ΔU
по температуре при постоянных давлении
и температуре соответственно:
 и
и
 (22)
(22)
 (23)
(23)
Производные энтальпии и внутренней энергии системы по температуре есть теплоемкости системы в изобарных и изохорных условиях Cp и Cv соответственно:
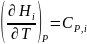 (24)
(24)
 (25)
(25)
Подставив выражения (24, 25) в (22, 23), получаем математическую запись закона Кирхгоффа:
 (26)
(26)
 (27)
(27)
Для химического процесса изменение теплоемкости задается изменением состава системы и рассчитывается следующим образом:
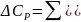 (28)
(28)
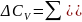 (29)
(29)
Если проинтегрировать выражения (26, 27) от Т = Т1 до Т = Т2, считая ΔСp (ΔСv) не зависящим от температуры, получим интегральную форму закона Кирхгоффа:
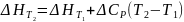 (30)
(30)
 (31)
(31)
Поскольку
обычно известны табличные значения
стандартных тепловых эффектов
 и
и ,
преобразуем выражения (30, 31):
,
преобразуем выражения (30, 31):
 (32)
(32)
 (33)
(33)
При расчете изменения теплового эффекта реакции в большом интервале температур необходимо учитывать зависимость теплоёмкости от температуры, которая выражается степенным рядом CP = a0 + а1T + а2T2 (теплоемкость органических веществ) и CP = a0 + а1T + а-2T-2; коэффициенты a0, а1, а2 и а-2 приведены в справочниках.
Стандартное состояние вещества
Для термохимических расчетов важен выбор стандартного состояния вещества. Стандартное состояние вещества – это его обычное состояние при 1 атм. Так, жидкая вода находится в стандартном состоянии; стандартное состояние углерода – графит и т.д.
Термодинамические
характеристики вещества, находящегося
в стандартном состоянии, обозначают
как
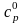 ,
,
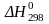 или
или
 .
.
Стандартная
теплота образования обозначается как
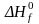 или
или
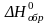 .
Для многих веществ величину стандартной
теплоты образования при стандартной
температуре
можно найти в справочниках термодинамических
величин. Для простых веществ
=
0. Стандартная теплота образования
–
наиболее часто используемая величина
в термохимических расчетах. Если
известны теплоты образования участников
реакции
.
Для многих веществ величину стандартной
теплоты образования при стандартной
температуре
можно найти в справочниках термодинамических
величин. Для простых веществ
=
0. Стандартная теплота образования
–
наиболее часто используемая величина
в термохимических расчетах. Если
известны теплоты образования участников
реакции
 ,
то её тепловой эффект равен:
,
то её тепловой эффект равен:
 .
.
В
уравнении индексы относятся к исходным
веществам и продуктам реации и их число
( и
и
 )
может изменяться от 1 до
и
)
может изменяться от 1 до
и
 .
.
Лекция 4 второе начало термодинамики. Энтропия
(слайд-лекция)
Первое начало термодинамики позволяет рассчитать энергетический эффект процесса, однако не дает ответа на вопросы о том, будет ли процесс протекать самопроизвольно, о направлении и глубине протекания процесса. Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать или обратимо, или необратимо. Хотя определение обратимого процесса уже приводилось, следует подробнее рассмотреть это понятие. Чтобы самопроизвольный процесс протекал обратимо, необходимо приложить извне такое сопротивление, чтобы переход был очень медленным и при бесконечно малом изменении противодействующей силы процесс мог пойти в обратном направлении. В случае обратимо происходящего изменения состояния системы производится максимальное количество работы. Всякий реальный процесс в какой-то степени является необратимым, и получаемая работа меньше максимально возможного теоретического количества.
Вынужденный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Второе начало термодинамики дает возможность определить:
- какой из процессов будет протекать самопроизвольно,
- какое количество работы может быть при этом получено,
- каков предел самопроизвольного течения процесса.
- какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени, что особенно важно для решения различных производственных задач.
Подобно первому, второе начало термодинамики выведено непосредственно из опыта. В то же время второе начало термодинамики имеет ограниченную область применения: оно применимо лишь к макроскопическим системам (т.е. системам, имеющим очень большое число частиц). Формулировки второго начала термодинамики:
Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому (Клаузиус).
Невозможен процесс, единственным результатом которого является превращение теплоты в работу.
Любая форма энергии переходит в теплоту, а теплота в свою очередь распределяется между телами наиболее равномерным способом (Томпсон).
Невозможно построить машину, все действия которой сводились бы к производству работы за счет охлаждения теплового источника (вечный двигатель второго рода).
Р
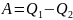
(34)
Отношение работы А, совершенной тепловой машиной, к количеству теплоты Q1, полученному от нагревателя, называется термодинамическим коэффициентом полезного действия (КПД) машины η:

Для
получения математического выражения
второго начала термодинамики рассмотрим
работу идеальной тепловой машины
(машины, обратимо работающей без трения
и потерь тепла; рабочее тело – идеальный
газ). Работа машины основана на принц ипе
обратимого циклического процесса
– термодинамического цикла Карно (рис.
1.2).
ипе
обратимого циклического процесса
– термодинамического цикла Карно (рис.
1.2).
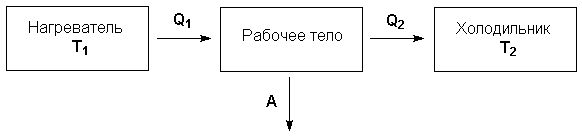
Рис. 1.1. Схема тепловой машины
Рис. 1.2. Цикл Карно
Запишем выражения для работы на всех участках цикла:
Участок 1 – 2: Изотермическое расширение.
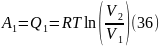
Участок 2 – 3: Адиабатическое расширение.

Участок 3 – 4: Изотермическое сжатие.

Участок 4 – 1: Адиабатическое сжатие.

Общая работа в цикле равна сумме работ на всех участках:

Проведя ряд несложных преобразований, получим для КПД идеальной тепловой машины, работающей по циклу Карно:

Т.о., максимальный КПД тепловой машины не зависит от природы рабочего тела, а определяется только разностью температур нагревателя и холодильника. Очевидно, что без перепада температур превращение теплоты в работу невозможно. Полученное выражение справедливо для тепловой машины, обратимо работающей по любому циклу, поскольку любой цикл можно разбить на множество бесконечно малых циклов Карно.
Для необратимо работающей тепловой машины уравнение (41) преобразуется в неравенство:
 (42)
(42)
Для общего случая можем записать:
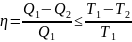 (43)
(43)
На основе анализа работы идеальной тепловой машины Карно можно сделать следующий вывод, являющийся также одной из формулировок второго начала термодинамики:
Любая форма энергии может полностью перейти в теплоту, но теплота преобразуется в другие формы энергии лишь частично.
Т.о., можно условно принять, что внутренняя энергии системы состоит из двух составляющих: "свободной" X и "связанной" Y энергий, причем "свободная" энергия может быть переведена в работу, а "связанная" энергия может перейти только в теплоту.
 (44)
(44)
Величина связанной энергии тем больше, чем меньше разность температур, и при T = const тепловая машина не может производить работу. Мерой связанной энергии является новая термодинамическая функция состояния, называемая энтропией.
Введем определение энтропии, основываясь на цикле Карно. Преобразуем выражение (I.41) к следующему виду:
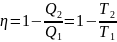 (45)
(45)
Отсюда получаем, что для обратимого цикла Карно отношение количества теплоты к температуре, при которой теплота передана системе (т.н. приведенная теплота) есть величина постоянная:
 (46)
(46)
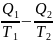 = 0 (47)
= 0 (47)
Это верно для любого обратимого циклического процесса, т.к. его можно представить в виде суммы элементарных циклов Карно, для каждого из которых
 (48)
(48)
Т.о., алгебраическая сумма приведённых теплот для произвольного обратимого цикла равна нулю:
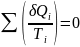 (49)
(49)
Выражение (49) для любого цикла может быть заменено интегралом по замкнутому контуру:
 (50)
(50)
Если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение есть полный дифференциал некоторой функции состояния; эта функция состояния есть энтропия S:
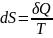 (51)
(51)
Выражение (51) является определением новой функции состояния – энтропии и математической записью второго начала термодинамики для обратимых процессов. Если система обратимо переходит из состояния 1 в состояние 2, изменение энтропии будет равно:
 (52)
(52)
Подставляя (51, 52) в выражения для первого начала термодинамики (1, 2) получим совместное аналитическое выражение двух начал термодинамики для обратимых процессов:
 (53)
(53)
 (54)
(54)
Для необратимых процессов можно записать неравенства:
 (55)
(55)
 (57)
(57)
Т.о., как следует из (57), работа обратимого процесса всегда больше, чем того же процесса, проводимого необратимо. Если рассматривать изолированную систему (δQ = 0), то легко показать, что для обратимого процесса dS = 0, а для самопроизвольного необратимого процесса dS > 0.
В изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся увеличением энтропии.
Энтропия изолированной системы не может самопроизвольно убывать.
Оба этих вывода также являются формулировками второго начала термодинамики.
