
- •Министерство образования и науки рф
- •Иркутский государственный технический университет физическая и коллоидная химия
- •260200 Производство продуктов питания
- •Иркутск 2012
- •Общие методические указания
- •Ниже приводится краткий консультативный материал в качестве помощника усвоения указанных тем Теплоемкость
- •Занятие 2.
- •2. Каталитические реакции
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем
- •Исходные данные
- •Математическая обработка экспериментальных данных. Интегрально-расчетный метод
- •Математическая обработка экспериментальных данных.
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •4. Агрегативная устойчивость
- •Далее приводится краткий консультативный материал в качестве помощника усвоения указанных тем.
- •Лекции семестра №4 Лекция 1
- •Раздел 1. Химическая термодинамика.
- •Тема 1.1. Законы термодинамики (исп. Видеофильм и слайд-лекция)
- •Лекция 2 Первое начало термодинамики
- •Работа расширения идеального газа в различных процессах
- •Лекция 3 Термохимия
- •Теплоемкость
- •Приближенные методы расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Лекция 4
- •Стандартное состояние вещества
- •Лекция 4 второе начало термодинамики. Энтропия
- •Статистическая интерпретация энтропии
- •Лекция 5 третье начало термодинамики
- •Термодинамические потенциалы
- •Лекция 6 химическое равновесие
- •Лекция 7
- •Лекция 8-10 фазовые равновесия (диаграммы двух и трёхкомпонентные на слайд-лекциях)
- •Лекция 11 Термодинамика растворов (слайд-лекции)
- •Образование растворов. Растворимость
- •Л екция 12 Растворимость твердых веществ в жидкостях
- •Лекция 13
- •Лекция 14
- •Лекция 15
- •Лекция 16
- •Лекция 17 электрохимические процессы
- •Лекция 18
- •Лекция 19 химическая кинетика
- •Лекция 20
- •Лекция 21
- •Лекция 22
- •Лекция 23
- •Лекция 24
- •Лекция 25 Коллоидная химия Адгезия, смачивание и растекание
- •Лекция 26 Адсорбция
- •Лекция 27
- •Лекция 28
- •Лекция 29
- •Лекция 30
- •Лекция 31
- •Лекция 32
- •Лекция 33
- •Лекция 34
- •Лекция35
- •Формы контроля по дисциплине и оценка качества подготовки
- •Литература
Лекция 3 Термохимия
Термохимия является разделом химической термодинамики и изучает тепловые эффекты, возникающие в результате химических реакций. Тепловой эффект – это количество теплоты, выделяющееся или поглощающееся во время химической реакции.
Исторически термохимия как наука возникла раньше химической термодинамики. В связи с чем возникли некоторые несоответствия в системе знаков («плюс» или «минус») у тепловых эффектов. Поэтому различают термохимический тепловой эффект (ТХТЭ) и термодинамический тепловой эффект (ТДТЭ). Термохимический тепловой эффект равен по абсолютной величине, но противоположен по знаку термодинамическому тепловому эффекту.
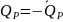
 (17)
(17)

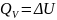 (18)
(18)
таким образом, ТХТЭ изобарный и изохорный равен по абсолютной величине, но противоположен по знаку изменению энтальпии и внутренней энергии соответственно.
Различают также экзотермический и эндотермический тепловой эффект.
Экзотермический
тепловой эффект
– это количество теплоты, выделяющееся
в окружающую среду во время реакции.
Система знаков здесь будет следующей:
< 0; т.е реакция протекает с уменьшением
энтальпии Н1
> Н2.
Однако, ТХТЭ (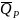 )
будет больше нуля.
)
будет больше нуля.
Эндотермический тепловой эффект – это количество теплоты, поглощающееся системой во время реакции. Здесь > 0; т.е. реакция протекает с увеличением энтальпии. Однако, ТХТЭ будет меньше нуля.
Теплоемкость
Теплоемкость (С, Дж/К) – это некоторое количество теплоты, подведенное к системе некоторой массы, изменяет ее температуру на некоторую величину.
В зависимости от количества теплоты различают истинную (Си, Дж/К) и среднюю ( , Дж/К) теплоемкость:
-Истинная теплоемкость – это дифференциально малое количество теплоты, подведенное к системе, изменяет ее температуру на дифференциально малую величину.
-Средняя теплоемкость – это количество теплоты, подведенное к системе, изменяет ее температуру на 1 К.
В зависимости от массы вещества различают удельную (Дж/кг∙К) и молярную (Дж/моль∙К) теплоемкость:
-Удельная теплоемкость – это количество теплоты, подведенное к 1 кг вещества.
-Молярная – это количество теплоты, подведенное к 1 моль (моль-экв) вещества
В зависимости от условий процесса различают изобарную (Ср, р = const) и изохорную (Сv, v = const) теплоемкости.
Изобарная и изохорная теплоемкости приблизительно равны между собой для конденсированных систем и отличаются друг от друга на величину универсальной газовой постоянной для газовых систем.
Приближенные методы расчета теплоемкости
Приближенные методы расчета теплоемкости применяют в случае отсутствия ее значения в справочной литературе. Ниже приводятся основные правила ее расчетов:
Правило Дюлонга и Пти: теплоемкость веществ в твердом состоянии при 25 0С одинакова и близка к 26,0 – 26,8 Дж/моль∙К. Исключение составляют некоторые легкие элементы: С, В, Ѕi и др.
Правило Ноймана –Коппа : мольная теплоемкость химического соединения при 25 0С равна сумме атомных теплоемкостей входящих в него элементов (или 26,4∙n, где n количество атомов, входящих в соединение, кроме исключения).
Правило аддитивности выполняется лучше, если для некоторых элементов принять более низкие значения атомных теплоемкостей, чем 26,4 (например, для водорода 9,614; для углерода - 7,524; для бора 11,286; для азота 12,54; для кислорода – 16,72; для фтора – 20,9; для кремния 15,884; для серы и фосфора – 22,572 Дж/мольК).
Теплоемкость жидкостей составляет в среднем около 33,44 Дж/мольК, а мольная теплоемкость жидких веществ приблизительно равна 33,44n (где n – число атомов в молекуле). Для легких элементов принимают меньшую атомную теплоемкость. Например, для углерода – 11,704; для водорода – 17,974; для бора 19,646; для кремния – 24,244; для кислорода 25,08; для фтора – 29,26; для фтора и фосфора – 30,932 Дж/мольК.
