
- •Ионообменные технологии
- •Содержание
- •Глава 3. Электроионитные процессы разделения и точной очистки веществ 81
- •Введение
- •Глава 1. Теоретические основы ионообменных процессов
- •1.1. Иониты. Классификация. Ионообменная емкость
- •1.1.1. Классификация ионитов
- •1.1.2. Ионообменная емкость
- •1.1.3. Методы определения обменной емкости
- •1.1.4 Способы выражения состава фаз
- •1.2. Кинетика ионного обмена
- •1.2.1. Пленочная кинетика
- •1.2.2. Гелевая кинетика
- •1.3. Ионообменное равновесие
- •1.3.1. Основные понятия
- •1.3.2. Изотермы сорбции
- •1.3.3. Методы изображения изотерм сорбции
- •1.3.4. Концентрационные константы ионообменного равновесия
- •1.3.5. Термодинамическая константа ионообменного равновесия
- •1.4. Термодинамика и кинетика разделительных процессов в системе ионит-раствор
- •Глава 2. Водоподготовка и деионизация растворов методами ионного обмена
- •2.1. Применение ионитов в процессах водоподготовки
- •2.1.1. Современное отечественное водоподготовительное оборудование
- •2.1.2. Развитие методов водоподготовки за рубежом
- •2.1.3. Технологическое и экологическое совершенствование водоподготовительных установок
- •2.1.4. Производство систем водоподготовки с применением мембран
- •2.1.5. Современные высокоэффективные коагулянты
- •2.1.6. Повышение эффективности реагентной обработки воды на водоподготовительных станциях России
- •2.1.7. Применение ионообменных смол при водоподготовке
- •Продукция фирмы «Пьюролайт Интернэшнл Лимитед» (Великобритания).
- •2.2. Деионизация растворов методом электродиализа с ионообменными мембранами
- •2.2.1. Примеры промышленных установок опреснения сточных вод
- •Глава 3. Электроионитные процессы разделения и точной очистки веществ
- •3.1. Разделение изотопов и ионов с близкими свойствами в обменных процессах с электрохимическим обращением потоков фаз
- •3.2. Разделение изотопов электроионитными методами
- •3.3. Разделение изотопов в системе ионит-раствор при наложении электрического поля
- •3.4. Разделение изотопических ионов при электродиализе с применением ионитовых мембран
- •Литература
1.3.3. Методы изображения изотерм сорбции
В виде графической зависимости между поглощенным количеством вещества единицей массы ионита: мг-экв/г, ммоль/г, г/г, и равновесным содержанием его в растворе: мг-экв/см3, ммоль/см3, г/л.
 Рис.
9. Изотермы сорбции на некоторых вофатитах.
Рис.
9. Изотермы сорбции на некоторых вофатитах.
Изотерма сорбции может быть построена на основе применения закона действующих масс к ионообменному равновесию (рис. 9).
В общем виде уравнение ионного обмена можно записать в виде:
![]()
На основании закона действующих масс, заменяя активности концентрациями ионов, имеем:
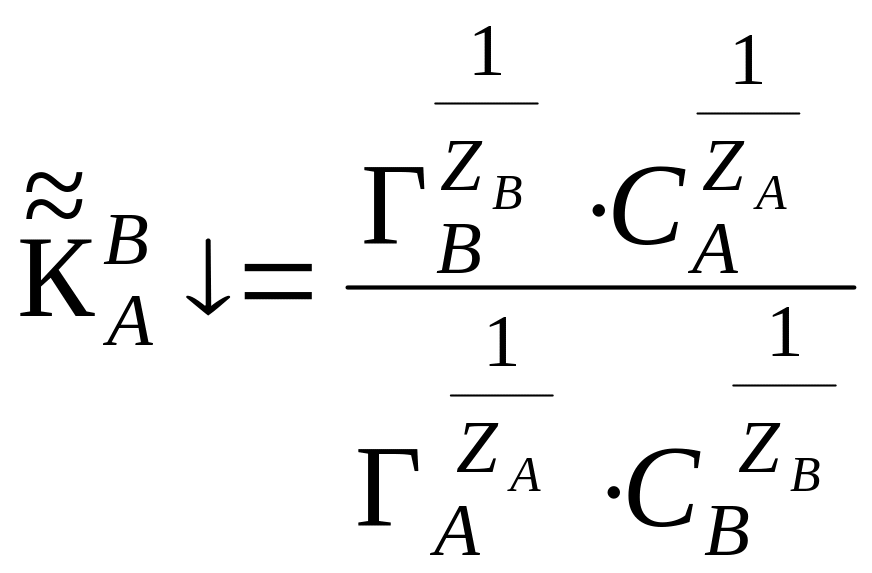 , (23)
, (23)
откуда
 ,
,
где
![]()
![]() –
эквивалентная (мольная) концентрационная
константа ионообменного равновесия.
Стрелка указывает, что ион В
замещает первоначально находившийся
в смоле ион A;
–
эквивалентная (мольная) концентрационная
константа ионообменного равновесия.
Стрелка указывает, что ион В
замещает первоначально находившийся
в смоле ион A;![]() – концентрация ионов в жидкой фазе,
мг-экв/см3
(ммоль/см3),
– концентрация ионов в жидкой фазе,
мг-экв/см3
(ммоль/см3),
![]() – концентрация ионов в ионите, мг-экв/г
(ммоль/г),
– концентрация ионов в ионите, мг-экв/г
(ммоль/г),
![]() – величины зарядов обменивающихся
ионов.
– величины зарядов обменивающихся
ионов.
При
построении графика изотермы сорбции
на оси ординат откладывается отношение
![]() – для разновалентных ионов или
– для разновалентных ионов или
![]() –
для одновалентных ионов. На оси абсцисс
откладывается отношение
–
для одновалентных ионов. На оси абсцисс
откладывается отношение
![]() или
или
![]() – для одновалентных ионов (рис. 10).
– для одновалентных ионов (рис. 10).
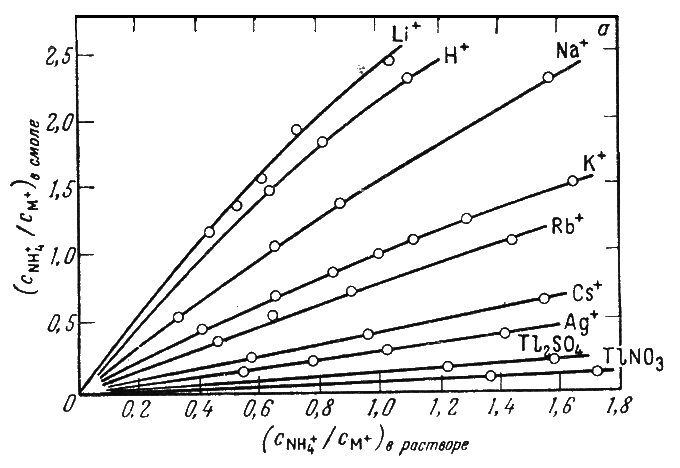
Рис. 10. Изотерма сорбции ионов щелочных элементов
По изотермам сорбции на рис. 10 определяются концентрационные константы равновесия
![]() ,
,
где угол наклона прямых к оси абсцисс.
Численные
значения
![]() не зависят от того, выражены ли концентрации
в мг-экв или ммолях.
не зависят от того, выражены ли концентрации
в мг-экв или ммолях.
![]() будет безразмерной величиной только
при обмене ионов одинаковой валентности.
будет безразмерной величиной только
при обмене ионов одинаковой валентности.
Изотерму сорбции строят также, откладывая на осях координат эквивалентные доли обменивающихся ионов, определяемых для ионита из уравнений (11-13), а для раствора (9-10).
Достоинством данного метода построения изотермы сорбции является изображение всего диапазона изменения концентраций обменивающихся ионов в интервале от 0 до 1.
Уравнение (21) в эквивалентных долях запишется
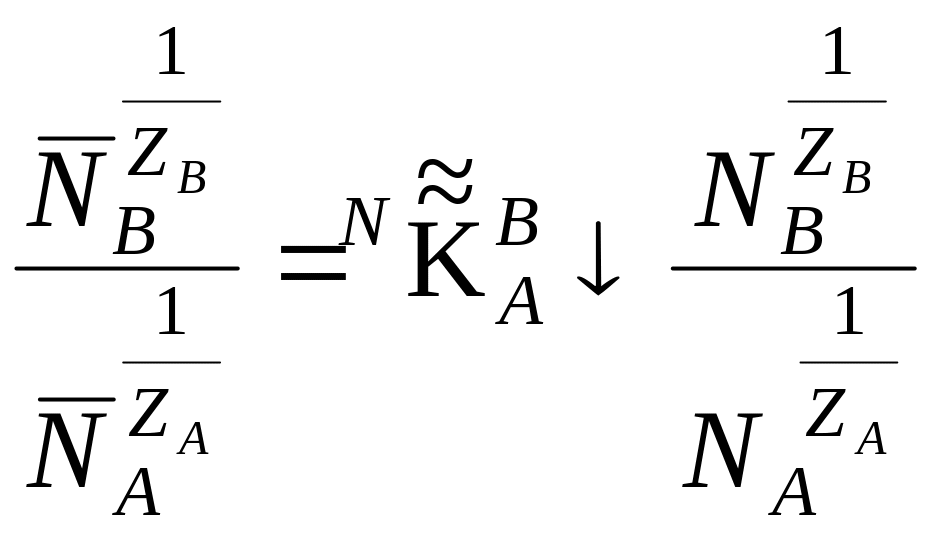 ,
,
или
 ,
,
где
![]() – рациональная концентрационная
константа равновесия.
– рациональная концентрационная
константа равновесия.
Численные
значения
=![]() только для случая обмена ионов одинаковой
валентности. Примеры изотерм сорбции,
построенных по эквивалентным долям
обменивающихся ионов в ионите и растворе
приведены на рис. 11.
только для случая обмена ионов одинаковой
валентности. Примеры изотерм сорбции,
построенных по эквивалентным долям
обменивающихся ионов в ионите и растворе
приведены на рис. 11.
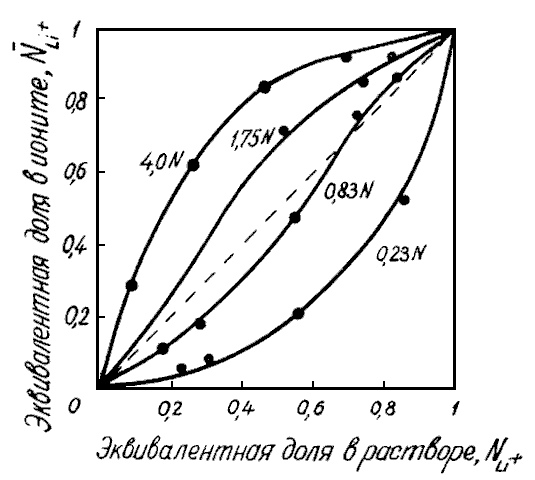
Рис.
11. Изотермы
сорбции
![]() на
катионите Дауэкс-5016
из водных растворов хлоридов различной
концентрации
на
катионите Дауэкс-5016
из водных растворов хлоридов различной
концентрации
Данный
метод построения изотермы позволяет
применять стандартные диаграммы для
определения числового значения
![]() или
или
![]() (рациональная константа концентрации
в молярных долях).
(рациональная константа концентрации
в молярных долях).
Приведем
график стандартной диаграммы (рис. 12).
Стандартная диаграмма равновесия при
различных значениях
![]()
![]() :
:
 (24)
(24)
![]() – молярная
доля Na
в ионите и растворе.
– молярная
доля Na
в ионите и растворе.
Пользуются
диаграммой следующим образом. Полученные
изотермы накладывают на стандартную
диаграмму и, экстраполируя к ближайшим
значениям
![]() ,
определяют значения рациональной
концентрационной константы равновесия.
,
определяют значения рациональной
концентрационной константы равновесия.
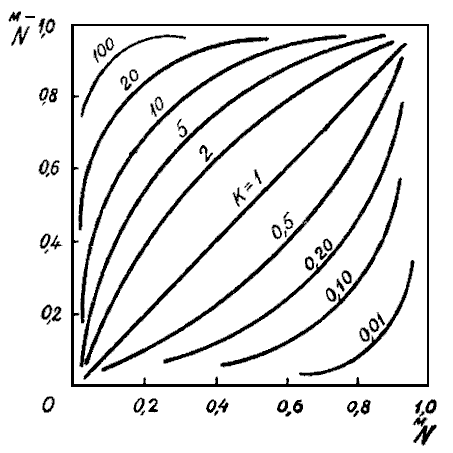
Рис. 12. Стандартные диаграммы изотермы сорбции
На основе изотерм сорбции решается ряд задач.
Так, зная константу равновесия определяются значения емкости ионита
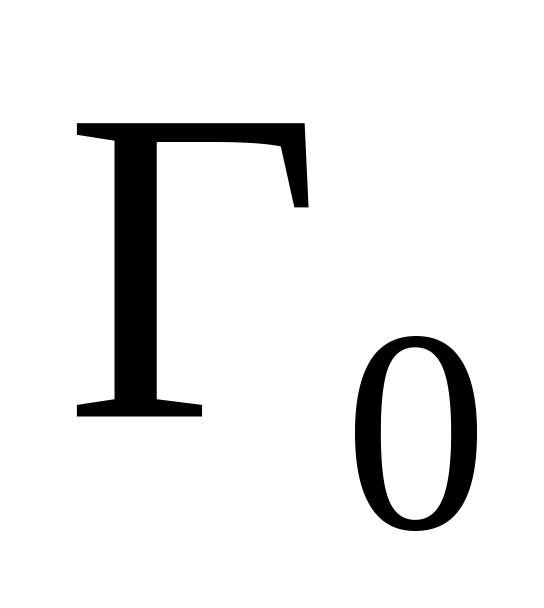 для случая поглощения данного количества
мг-экв иона
для случая поглощения данного количества
мг-экв иона
 навеской ионита М
из объема V
с концентрацией С0.
навеской ионита М
из объема V
с концентрацией С0.Можно определить поглощение иона B при данном составе жидкой фазы и константы равновесия
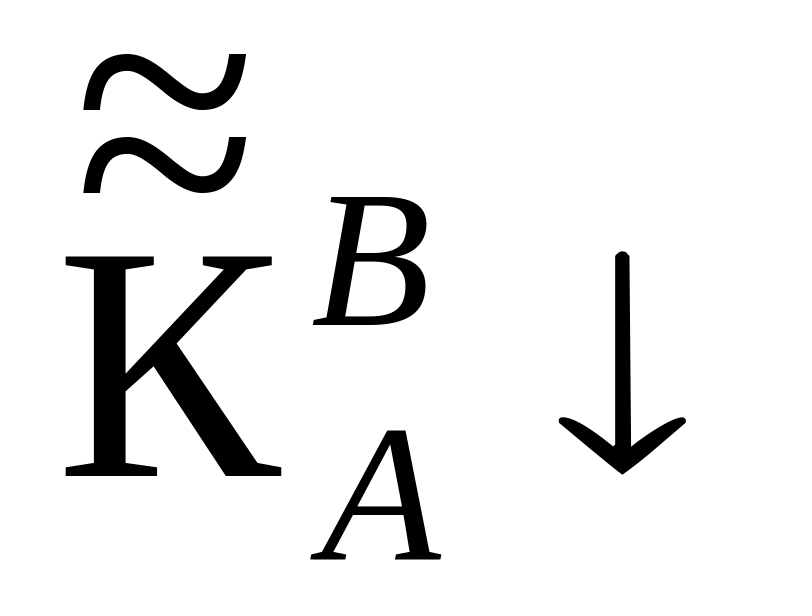 по уравнениям
по уравнениям
 ,
,
![]() .
.
