
- •Ионообменные технологии
- •Содержание
- •Глава 3. Электроионитные процессы разделения и точной очистки веществ 81
- •Введение
- •Глава 1. Теоретические основы ионообменных процессов
- •1.1. Иониты. Классификация. Ионообменная емкость
- •1.1.1. Классификация ионитов
- •1.1.2. Ионообменная емкость
- •1.1.3. Методы определения обменной емкости
- •1.1.4 Способы выражения состава фаз
- •1.2. Кинетика ионного обмена
- •1.2.1. Пленочная кинетика
- •1.2.2. Гелевая кинетика
- •1.3. Ионообменное равновесие
- •1.3.1. Основные понятия
- •1.3.2. Изотермы сорбции
- •1.3.3. Методы изображения изотерм сорбции
- •1.3.4. Концентрационные константы ионообменного равновесия
- •1.3.5. Термодинамическая константа ионообменного равновесия
- •1.4. Термодинамика и кинетика разделительных процессов в системе ионит-раствор
- •Глава 2. Водоподготовка и деионизация растворов методами ионного обмена
- •2.1. Применение ионитов в процессах водоподготовки
- •2.1.1. Современное отечественное водоподготовительное оборудование
- •2.1.2. Развитие методов водоподготовки за рубежом
- •2.1.3. Технологическое и экологическое совершенствование водоподготовительных установок
- •2.1.4. Производство систем водоподготовки с применением мембран
- •2.1.5. Современные высокоэффективные коагулянты
- •2.1.6. Повышение эффективности реагентной обработки воды на водоподготовительных станциях России
- •2.1.7. Применение ионообменных смол при водоподготовке
- •Продукция фирмы «Пьюролайт Интернэшнл Лимитед» (Великобритания).
- •2.2. Деионизация растворов методом электродиализа с ионообменными мембранами
- •2.2.1. Примеры промышленных установок опреснения сточных вод
- •Глава 3. Электроионитные процессы разделения и точной очистки веществ
- •3.1. Разделение изотопов и ионов с близкими свойствами в обменных процессах с электрохимическим обращением потоков фаз
- •3.2. Разделение изотопов электроионитными методами
- •3.3. Разделение изотопов в системе ионит-раствор при наложении электрического поля
- •3.4. Разделение изотопических ионов при электродиализе с применением ионитовых мембран
- •Литература
1.2. Кинетика ионного обмена
В процессе ионного обмена происходит изменение концентрации вещества (веществ) в растворе (пульпе) и ионите во времени. Знание закономерностей этого процесса (качественных и количественных) необходимо при рассмотрении механизма, расчете оборудования и получении информации о равновесном распределении элементов.
Ионообменный процесс складывается из трех стадий:
– диффузии обменивающихся ионов от или к поверхности раздела фаз;
– диффузии обменивающихся ионов внутри зерна ионита в противоположных направлениях;
– химической реакции двойного обмена, причем последняя стадия характеризует химическую кинетику, а две первые – имеют диффузионный характер.
Скорость многостадийного процесса определяется скоростью наиболее медленной стадий.
Большинство экспериментальных данных по ионному обмену, полученных в статических и динамических условиях, показали, что скорость процесса определяется диффузионными стадиями – внешней (1 стадия) или внутренней (2 стадия) диффузией, т.е. скорость ионного обмена весьма существенно зависит от размера зерен катионита или анионита [22].
Перенос вещества в случае диффузионной кинетики определяется законами Фика:
для внешней диффузии
![]() ; (16)
; (16)
для внутренней диффузии
![]() (17)
(17)
Относительная роль внешней или внутренней диффузии будет зависеть от диффузионного потока и аппаратурного оформления. Внешнедиффузионная кинетика будет проявляться в очень разбавленных растворах (пульпах), на сорбентах с высокой емкостью и малым числом поперечных связей. В этом случае скорость процесса будет зависеть от гидродинамических факторов – от интенсивности перемешивания. Внутридиффузионная кинетика будет, очевидно, преобладать в концентрированных растворах (пульпах) на сорбентах с большим числом поперечных связей и т. д.
Механизм ионного обмена можно оценить различными способами по соотношениям [19]:
при
внутренней диффузии: ![]() ;
;
при
внешней диффузии: ![]() ;
;
при
смешанной диффузии: ![]() .
.
Здесь
y=ΣZiyi,
x=ΣXiZi
– суммарные концентрации обменивающихся
ионов в твердой и жидкой фазах;
![]() – коэффициент
разделения обоих сортов противоионов
в равновесном состоянии: ион А
первоначально
находится в ионите, В
– в растворе.
Приводятся и несколько другие критерии
оценки лимитирующей стадии:
– коэффициент
разделения обоих сортов противоионов
в равновесном состоянии: ион А
первоначально
находится в ионите, В
– в растворе.
Приводятся и несколько другие критерии
оценки лимитирующей стадии:
при
внешней диффузии
![]() ;
при
внутренней
;
при
внутренней
![]() .
.
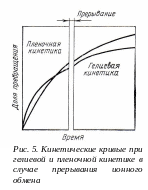
Наиболее просто и надежно лимитирующую стадию найти экспериментально методом прерывания (рис. 5) [17]. При внешнедиффузионной стадии кривая насыщения не имеет перегиба после прекращения перемешивания, а при внутридиффузионной – скорость начального процесса выше, так как при прерывании процесса концентрация в зерне для этого случая выравнивается и в начальный момент скорость процесса возрастает из-за большего градиента концентрации.
П
 ри
смешанно-диффузионном механизме даже
метод прерывания не всегда дает
однозначный ответ – влияет ли диффузионное
сопротивление в жидкой пленке на границе
раздела фаз на кинетику процесса. Поэтому
механизм исследуемого процесса оценивают
также по зависимости скорости ионного
обмена от диаметра частиц, графическим
методом интерпретации кинетических
данных в виде
ри
смешанно-диффузионном механизме даже
метод прерывания не всегда дает
однозначный ответ – влияет ли диффузионное
сопротивление в жидкой пленке на границе
раздела фаз на кинетику процесса. Поэтому
механизм исследуемого процесса оценивают
также по зависимости скорости ионного
обмена от диаметра частиц, графическим
методом интерпретации кинетических
данных в виде
![]() для
внешнедиффузиониой кинетики и
для
внешнедиффузиониой кинетики и
![]() – для
начального периода внутренней.
Используется, кроме того, критерий Био:
– для
начального периода внутренней.
Используется, кроме того, критерий Био:
![]() .
При
.
При
![]() – внешняя диффузия,
– внешняя диффузия,
![]() – внутренняя,
– внутренняя,
![]() – смешанная [19].
В некоторых
случаях бывает сложнее установить
определяющую стадию по мере проведения
процесса в аппарате непрерывного
действия, так как по ходу изменения
концентрации относительная роль внешней
или внутренней диффузии может меняться.
При расчете оборудования такие моменты
необходимо учитывать, поэтому нужно
использовать несколько способов анализа,
чтобы определить лимитирующую стадию
в зависимости от гидродинамических,
концентрационных, геометрических и
других факторов.
– смешанная [19].
В некоторых
случаях бывает сложнее установить
определяющую стадию по мере проведения
процесса в аппарате непрерывного
действия, так как по ходу изменения
концентрации относительная роль внешней
или внутренней диффузии может меняться.
При расчете оборудования такие моменты
необходимо учитывать, поэтому нужно
использовать несколько способов анализа,
чтобы определить лимитирующую стадию
в зависимости от гидродинамических,
концентрационных, геометрических и
других факторов.
