
- •31. Для каких веществ можно использовать очистку сублимацией и дистилляцией? Дайте определение этих процессов.
- •32. Изобразите зависимость давления насыщенного пара над раствором от его состава для идеальных и неидеальных растворов. Приведите соответствующие аналитические выражения.
- •33. Изобразите возможные зависимости температуры кипения раствора от его состава.
- •34. Покажите, каким образом можно разделить двухкомпонентный раствор на отдельные компоненты.
- •52. Особенности выращивания монокристаллов разлагающихся полупроводниковых и диэлектрических соединений методом вытягивания из расплава.
- •53. Преимущества методов вытягивания из расплава по сравнению с методом нормальной направленной кристаллизации.
- •54. Изобразите схему и опишите получение монокристаллов методом зонной плавки.
- •55. Преимущества метода плавающей зоны. Способы удержания расплавленной зоны. Для каких материалов рекомендуется использовать метод?
- •56. Опишите метод выращивания монокристаллов с пьедестала. Достоинства и недостатки метода.
- •57. Метод Вернейля.
- •76. Механическая подпитка расплава жидкой фазой.
- •77. Механическая подпитка расплава газовой фазой.
- •78. Перечислите важнейшие факторы, влияющие на локальную неоднородность состава кристалла.
- •79. Каким образом гидродинамические потоки в расплаве влияют на толщину диффузионного слоя и локальную неоднородность состава кристалла? Какие условия обеспечат максимальную однородность кристалла?
1. Технологический процесс получения материалов ЭТ
Это совокупность способов и процедур переработки сырья в проводники, полупроводники, диэлектрики и магнитные материалы.
2. Основные стадии технологических процессов получения ЭТ
Основные процессы - химико-технологического толка.
3. Определение технологического режима
Совокупность основных параметров, которые влияют на скорость процесса, выход и качество продукта (давление, температура).
4. Классификация ТП по характеру протекания во времени
Существуют следующие виды процессов: периодический (единство места протекания отдельных стадий и не установившееся состояние во времени), непрерывный (единство времени протекания всех стадий, установившееся состояние и непрерывный отбор конечного продукта), а также комбинированный.
5. Основные стадии химического процесса в технологии материалов ЭТ
Подготовка сырья и подвод реагирующих компонентов в реактор, химические превращения и реакции, отвод полученных продуктов и выделение целевого продукта.
6. Дайте определение лимитирующей стадии процесса
Лимитирующая стадия - это та стадия процесса, которая идет дольше других. Именно она определяет скорость протекания процесса.
7. Как определить лимитирующую стадию гетерогенного процесса ?
Нужно знать в какой области протекает процесс: кинетической, переходной или диффузионной. Если лимитирующая стадия - подвод или отвод реагентов, то процесс протекает в диффузионной области; если лимитирующая стадия - химическая реакция, то процесс протекает в кинетической области.
8. Как увеличить скорость процесса, протекающего в диффузионной области ?
Необходимо ввести перемешивание реагентов в случае массопереноса через раздел фаз, также возможно измельчение компонентов, температура оказывает слабое влияние.
9. Как увеличить скорость процесса, протекающего в кинетической области ?
Для кинетической области необходимо повысить температуру и увеличить площадь раздела фаз.
10. Дайте определение нормального и активного состояния твердофазных реагентов.
Нормальным принято называть состояние твердых тел, дефектность которых обусловлена собственным разупорядочением решетки. Активным называют состояние твердых тел, характеризующееся наличием неравновесных дефектов.
11. Какими способами можно активизировать твердофазные реагенты ?
Механоактивация (измельчение, диспергирование), ударная волна, лазерное излучение, ввод примесей.
12. За счет каких факторов удается увеличить скорость процесса при измельчении твердых тел?
Скорость химико-технологического процесса получения материалов ЭТ прежде всего увеличивается с увеличением площади поверхности контактирующих фаз, поэтому исходное сырье подвергают измельчению.
13. Дробление, помол, степень измельчения ?
K = d1 / d2 - степень измельчения (крупные - d1 > 250 мм, n = 2 - 6; средние - d1 = 50 - 250 мм, n = 5 - 10; мелкие - d1 = 20 - 50 мм, n = 10 - 50; очень маленькие - d1 = 3 мм, n > 60). Дробление - уменьшение кусков исходного материала, иногда под дроблением понимают измельчение очень больших тел на очень мелкие. Помол: грубый (1000—500 мкм), средний (500—100 мкм), тонкий (100-40 мкм) и сверхтонкий (< 40 мкм). Цель помола — увеличение дисперсности твёрдого материала, придание ему определённого гранулометрического состава и формы частиц, дезагрегирование.
14. Назовите способы измельчения твердых тел.
Способы: давление, удар, истирание, раскалывание. Чаще всего реализуется комбинация этих методов и выбор способа измельчения определяют свойствами сырья. Для твердых тел используют давление и удар, для пластичных - истирание, для хрупких - раскалывание.
15. Какое оборудование применяется для грубого измельчения, какое - для мелкого?
Для грубого: щековая дробилка, конусная дробилка. Для мелкого: валиковая дробилка (мельница), бегунковая дробилка, шаровая мельница.
16. С какой целью проводят грохочение ? Приведите различные схемы измельчения.
Для разделения или рассева измельченных материалов на фракции с зернами приблизительно одинакового размера применяют грохочение или ситовую классификацию. Проводят с помощью грохотов или сит.
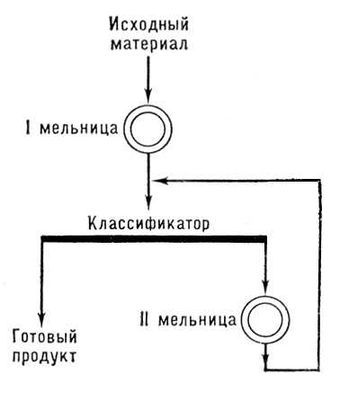
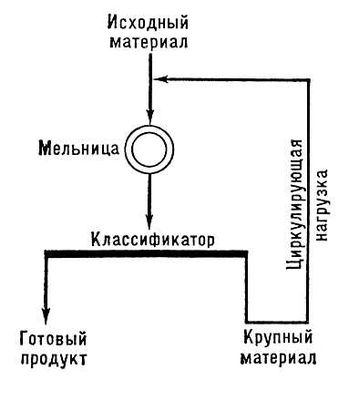
Открытый и закрытый циклы измельчения
17. Поясните обозначения: Ti 007ВЭЧ5-6; Au ОСЧ11-5.
Ti 007ВЭЧ5-6 - титан, вещество эталонной чистоты, общее содержание примеси 0,007%, основное вещество 99,993%, 5 - количество нежелательных примесей, 6 - концентрация нежелательных примесей (10-6 %); Au ОСЧ11-5 - золото, особо чистое вещество, 11 - число нежелательных примесей, 5 - общее содержание нежелательных примесей (10-5 %).
18. Приведите классификацию процессов разделения и очистки.
- Основанные на сорбции (адсобрция, ионный обмен, хроматография)
- Основанные на экстракции (жидкостные)
- Кристаллические процессы
- Процессы связанные с перегонкой через газовую фазу (сублимация, дистилляция, ректификация, химический транспорт)
- Процессы, основанные на электролизе
- Процессы, основанные на различиях в коэффициенте диффузии
- Избирательное осаждение, окисление, восстановление.
19. Дайте определение чистого вещества.
Чистое вещество - вещество считается достаточно чистым если содержание примеси в нем меньше того количества, которое мешает использовать это вещество для заданной цели.
20. На чем основаны очистка и разделение веществ с помощью адсорбции?
Очистка адсорбцией основана на том, что адсорбция избирательна. Адсорбируются только те вещества, которые понижают свободную энергию на поверхности адсорбента.
21. Что является количественной характеристикой адсорбции?
Количественной характеристикой адсорбции является изотерма адсорбции.

Изотерма адсорбции (С- концентрация в растворе, Сs - концентрация на поверхности)
22. Назовите вещества, используемые в качестве сорбентов.
В качестве материалов адсорбентов используют: силикогель (применяется для очистки неполярных растворов от полярных примесей), активированный уголь (большая уд. поверхность пор), пористые алюмосиликаты.
23. Дайте определение ионного обмена. Чем ионный обмен отличается от адсорбции?
Ионный обмен представляет собой обратимый взаимообмен заряженных ионов между жидким раствором и твердым нерастворимым веществом (ионит), находящимся в контакте с раствором электролита. Ионный обмен происходит стехиометрически.
24. Приведите примеры реакций ионного обмена.
2NaXтв + CaCl2 = CaX2тв + 2NaCl - катионный обмен
2XClтв + Na2SO4 = X2SO4тв + 2NaCl - анионный обмен
HX2OHтв + KCl = KX2Clтв + H2O - амфотерный обмен
25. Изобразите схематическое изображение ионита. Механизм ионного обмена.
При ионном обмене в ионит проникает некоторое количество ионов – загрязнителей того же знака, что и противоионы, и одновременно эквивалентное количество противоионов вытесняется в раствор. В ионит могут проникать ионы того же знака, что и фиксированные ионы, так называемые коионы (от лат. приставки «ко» – совместно). Поэтому содержание противоионов в ионите обусловлено не только зарядом каркаса, но и содержанием коионов.
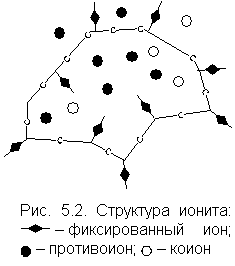
Структура ионита
26. Изобразите изотерму ионного обмена для реакции СтВ + D+ = DTB+ + С+, если ионит предпочтительнее поглощает ионы D+.
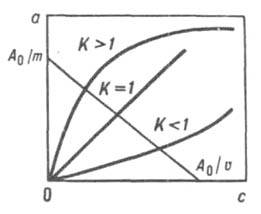
Изотермы ионного обмена
Нужная кривая - при К > 1.
27. Что такое коэффициент разделения в ионном обмене? Какие значения он может принимать?
Коэффициент разделения - отношение доли противоионов в ионите к доле противоионов в растворе.
 (значения
>1, 1<, =1)
(значения
>1, 1<, =1)
28. Какой раствор (рабочий или после промывки) является ценным при использовании ионита для:
для выделения ценного элемента, сорбируемого ионитом, из большой массы слабого раствора;
очистки раствора от примесей;
разделения двух элементов, один из которых сорбируется, а другой остается в растворе. (?)
Предположительно: после промывки, рабочий, после промывки (?)
29. Что лежит в основе хроматографического способа разделения веществ?
Хроматографический способ разделения основан на различном сорбировании компонентов разделяемой смеси, это приводит и к различной скорости перемещении компонентов при ее движении через пористую среду.
30. Приведите и прокомментируйте схемы основных методов жидкостно — адсорбционной хроматографии?
Основными методами жидкостно-адсорбционной хроматографии является фронтальный, проявительный, вытеснительный.

Основные варианты проведения хроматографического процесса: а — фронтальный; б — проявительный; в — вытеснительный; 1, 2, 3, 4 — разделяемые вещества; C — несорбирующаяся подвижная фаза; D — вытеснитель.
При фронтальном варианте в слой сорбента непрерывно вводится разделяемая смесь, состоящая из газа-носителя и разделяемых компонентов, например 1, 2, 3, 4, которая сама является подвижной фазой. Через некоторое время после начала процесса наименее сорбируемый компонент (например, 1) опережает остальные и выходит в виде зоны чистого вещества раньше всех, а за ним в порядке сорбируемости последовательно располагаются зоны смесей компонентов: 1 + 2, 1 + 2 + 3, 1 + 2 + 3 + 4 (рис., a). При проявительном варианте через слой сорбента непрерывно проходит поток элюента и периодически в слой сорбента вводится разделяемая смесь веществ. Через определённое время происходит деление исходной смеси на чистые вещества, располагающиеся отдельными зонами на сорбенте, между которыми находятся зоны элюента (рис., б). При вытеснительном варианте в сорбент вводится разделяемая смесь, а затем поток газа-носителя, содержащего вытеснитель (элюент), при движении которого смесь через некоторый период времени разделится на зоны чистых веществ, между которыми окажутся зоны их смеси (рис., в).
31. Для каких веществ можно использовать очистку сублимацией и дистилляцией? Дайте определение этих процессов.
Дистилляция представляет собой процесс разделения жидкости раствора нас составные части путем их испарения и последующей конденсации паров. Возгонка как метод разделения возможен для тех веществ, которые будучи нагретыми до температуры ниже температуры плавления обладают достаточно высоким давлением собственных паров. Если в в-ве содержится примеси обладающие различной летучестью, то более летучие, по сравнению с основным веществом, при более низкой температуре.
32. Изобразите зависимость давления насыщенного пара над раствором от его состава для идеальных и неидеальных растворов. Приведите соответствующие аналитические выражения.
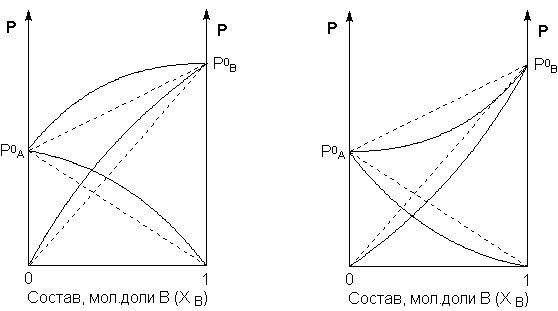
![]()
33. Изобразите возможные зависимости температуры кипения раствора от его состава.

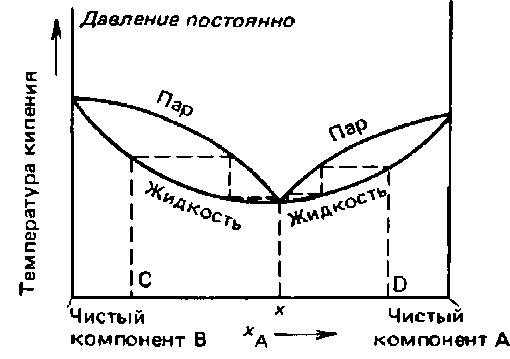
34. Покажите, каким образом можно разделить двухкомпонентный раствор на отдельные компоненты.
Если нагреть раствор состава N1, то при температуре T1 он начнет кипеть. Пар, равновесный с этим раствором будет обладать составом N3, который более богат компонентом B, чем раствор. После испарения из раствора некоторого кол-ва жидкости, оставшаяся его часть становится более богатой компонентом А и имеет состав N2. Раствор этого состава начнет кипеть при Т2, а пар находящийся в равновесии с этим раствором будет иметь состав N4 с более высоким содержанием компонента B, чем раствор. Таким образом по мере испарения раствор обогащается компонентом А и температура кипения повышается. В результате останется только чистый А, с температурой кипения Ta.
35. Что такое коэффициент распределения и коэффициент разделения для процессов дистилляции?
Количественной мерой процесса дистилляции как процесса разделения и очистки является коэффициент перераспределения:
КА = NA' / NA (NA' - конц. А в паре, NA - конц. А в растворе) - коэффициент перераспределения, аналогично для В.
КP = КА / КB - коэффициент разделения
36. Какие факторы влияют на эффективность процесса очистки и разделения методом дистилляции?
Эффективность и качество процессов разделения и очистки веществ сублимацией и дистилляцией зависит от следующих факторов:
- примесный состав очищаемого вещества
- величина поверхности раздела фаз
- температура вещества и конденсатора
- давление и состав газов в аппарате
37. Каким образом остаточные газы влияют на процессы разделения и очистки при дистилляции?
Остаточные газы могут иметь двоякое влияние процесс разделения и очистки, нейтральные газы не влияют активность компонентов, приводят к увеличению скорости движения частиц к конденсатору. Сублимацию и дистилляцию лучше проводить в вакууме. Химически активные газы могут влиять на коэффициент активности газов и по разному влиять на эффективность перегонки.
38. Чем ректификация отличается от дистилляции?
Ректификация это многостадийный процесс, включающий в себя множество повторяющихся стадий дистилляции и конденсации.
39. Дайте определение химических транспортных реакций (ХТР).
Химические транспортные реакции (реакции переноса) - обратимые гетерогенные реакции с участием газовой фазы, приводящие к образованию промежуточных газообразных продуктов, с помощью которых осуществляется перенос вещества между двумя реакционными зонами с различной температурой или давлением.
40. Для очистки каких веществ рекомендуется применять ХТР?
ХТР применяют для веществ, для которых в следствие недостаточной упругости паров невозможно применять методы дистилляции и сублимации.
41. Приведите пример ХТР и поясните, как происходит очистка компонента.
Si(тв) + SiCl4(г) = (Т1, 1300о) = 2SiCl2(г) - гетерогенная реакция газообразного реагента с в-вом источника
2SiCl2(г) = (Т2, 1100о) = SiCl4(г) + Si(тв) - перемещение газообразных соединений от источника к зоне осаждения
Si(тв) + SiCl4(г) = (T1 - T2) = 2SiCl2(г) - гетерогенная реакция, в результате которой выделяется очищаемый компонент.
42. Назовите основные типы ХТР и приведите реакции.
Основные типы реакций ХТР:
- эндотермические обратимые реакции с вытеснением (восстановление)
Si(тв) + 4HCl(г) = (>500 - 800о, <1100 - 1200о) = SiCl4(г) + 2H2(г)
- реакция образования соед. пониж. валентн. с их послед. диспропорц.
Cu(тв) + GeI4(г) = (>600, <400) = 2GeI2
- реакция синтеза и термич. диссоциация летуч. соед
43. Изобразите и прокомментируйте основные схемы осуществления процессов очистки веществ с помощью ХТР.
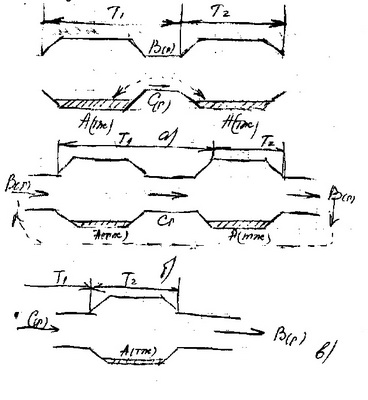
а) процесс замкнутый, перенос осуществляется молекулами или конвективной диффузией без принудительного потока
б) процесс замкнутый, транспорт осуществляется принудительным потоком газа реагента либо газа носителя
в) процесс разомкнутый, синтез и очистка очищаемого вещества проводится вне реактора
44. Перечислите основные недостатки метода очистки веществ с помощью ХТР.
При очистке по открытому циклу требуется тщательная очистка газа реагента и газа носителя, также требуется большое количество в-ва реагента. В замкнутом цикле требуется многоступенчатая очистка, либо предварительная очистка вещества другим методом.
45. Опишите гомогенный и гетерогенный механизмы образования центров кристаллизации.
В различных точках исходной фазы, находящейся в тепловом равновесии, непрерывно наблюдаются флуктуации температуры, плотности. В результате флуктуации может происходить образование зародыша новой фазы (гетерогенная флуктуация). Если новая фаза не образуется - гомогенная флуктуация.
46. Назовите основные методы получения монокристаллов из твердой фазы. Достоинства и недостатки метода.
- Рекристаллизация посредством отжига, деформаций в тв. теле и при спекании
- Перекристаллизация при полиморфных превращениях
- Перекристаллизация из аморфных соединений
Достоинства: процессы можно проводить при относительно низких температурах, т.е. ниже темп. плавления; упрощается процесс получения монокристаллов заданной формы или профиля, т.к. форма задается заранее; в следствие невысокой темп. и низкой скорости диффузии в тв. фазе распределение примесей в растущем кристалле сохранится таким же как и в исх. материале.
Недостатки: высокая концентрация зародышей, невозможность получить монокристалл большого размера.
47. Опишите получение монокристаллов методом нормальной направленной кристаллизации.
Обязательным является использование тигля, т.е. расплавление кристалла происходит в контакте со стенками тигля. Создание переохлаждения осуществляется перемещением тигля относительно нагревателя, нагревателя относительно тигля, а также за счет охлаждения тигля с расплавом в тепловом поле с температурным градиентом.
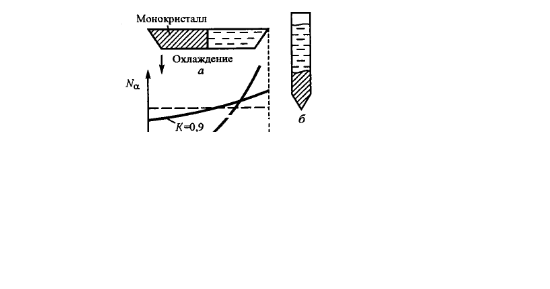
48. Какие требования предъявляются к материалу тигля в методе нормальной направленной кристаллизации. Какие материалы используются?
Тигель должен быть изготовлен из химически стойкого к расплаву и газовой атмосфере материала, также он должен иметь сходный или равный температурный коэффициент линейного расширения как и расплавляемый кристалл. Материалы: молибден, ирридий, платина, графит.
49. Каким образом можно организовать процесс выращивания монокристаллов методом нормальной направленной кристаллизации?
Оборудование для проведения ННК:
- Тигель из хим. стойкого материала к расплаву и газовой атмосфере
- Печь
- Система регулировки температуры
- Устройство для механического перемещения тигля или нагревателя
50. Изобразите схему и перечислите основные этапы получения монокристаллов методом вытягивания из расплава?
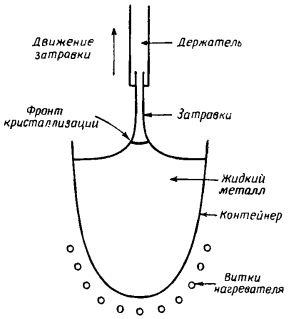
Основные этапы: расплавление загрузки при температуре несколько выше температуры плавления (удаление летучих примесей); затравка опускается и выдерживается над расплавом для уменьшения термоудара; затравка опускается в расплав и оплавляется; выращивание шейки монокристалла; выход на диаметр.
51. Влияние тепловых условий на различные факторы при выращивании монокристаллов методом вытягивания из расплава.
Тепловые условия являются одними из важнейших параметров, определяющих размеры и качество выращиваемых монокристаллов. Они определяют градиент температуры в растущем кристалле и расплаве, а следовательно и форму фронта кристаллизации, диаметр и скорость роста, термические напряжения. Необходимо соблюдать равенство тепловых потоков, которые поступают из расплава и выделяются в результате кристаллизации и теплового потока отвод. от кристалла.
Q(0) = Q(p) + Q(k)
