
- •10 Класс. Зачёт № 4. Опорный конспект № 1
- •10 Класс. Зачёт № 4. Опорный конспект № 3
- •10 Класс. Зачёт № 4. Опорный конспект № 2
- •10 Класс. Зачёт № 3. Опорный конспект № 1
- •10 Класс. Зачёт № 3. Опорный конспект № 2
- •10 Класс. Зачёт № 1. Опорный конспект № 1
- •10 Класс. Зачёт № 2. Опорный конспект № 1
- •10 Класс. Зачёт № 2. Опорный конспект № 2
- •10 Класс. Зачёт № 2. Опорный конспект № 3
10 Класс. Зачёт № 3. Опорный конспект № 1
Тема “ Молекулярно-кинетическая теория”
Молекулярно-кинетическая теория ( м.к.т. ) изучает свойства вещества на основе его внутреннего строения. Основные положения м.к.т. :
1.
Все вещества состоят из частиц.
2. Размеры молекул составляют
примерно
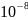 см.
3. Между
молекулами есть промежутки.
4. Молекулы непрерывно, беспорядочно
двигаются.
5. Между молекулами действуют
силы притяжения и отталкивания.
см.
3. Между
молекулами есть промежутки.
4. Молекулы непрерывно, беспорядочно
двигаются.
5. Между молекулами действуют
силы притяжения и отталкивания.
Такие
явления, как дробление, растворение,
диффузия, смачивание, слипание веществ
доказывают основные положения м.к.т.
Для более простого описания
поведения молекул ввели понятие
идеального газа. Идеальным
газом называется газ, молекулы которого
представляют собой упругие шарики,
которые взаимодействуют только при
столкновении.
Идеальный газ
характеризуется микро- и макроскопическими
параметрами. Микроскопические параметры
относятся к одной молекуле. Это
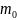 - масса одной молекулы, которая
измеряется в атомных единицах массы [
а.е.м.]. 1 а.е.м. =
1,66×
- масса одной молекулы, которая
измеряется в атомных единицах массы [
а.е.м.]. 1 а.е.м. =
1,66×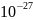 кг
, а также средняя скорость одной молекулы
v
, которая составляет несколько сотен
м/с. Макроскопические параметры относятся
ко всему газу в целом. Это количество
вещества ν [ моль ]. 1 моль содержит
кг
, а также средняя скорость одной молекулы
v
, которая составляет несколько сотен
м/с. Макроскопические параметры относятся
ко всему газу в целом. Это количество
вещества ν [ моль ]. 1 моль содержит
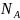 = 6 ×
= 6 ×
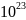 1/моль молекул.
называется числом Авогадро. Количество
вещества можно вычислить по формулам:
1/моль молекул.
называется числом Авогадро. Количество
вещества можно вычислить по формулам:
ν
=
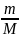 или ν =
или ν =
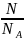 , где m
– масса всего газа, M
– масса 1 моля газа, N
– количество молекул. К макроскопическим
параметрам относятся также давление
газа Р [ ПА ], объём газа V
[
, где m
– масса всего газа, M
– масса 1 моля газа, N
– количество молекул. К макроскопическим
параметрам относятся также давление
газа Р [ ПА ], объём газа V
[
 ], температура t
], температура t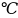 ,
которая измеряется по шкале Цельсия, и
температура Т
,
которая измеряется по шкале Цельсия, и
температура Т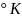 ,
которая измеряется по шкале Кельвина.
Эти температуры связаны формулой: T
= t
+ 273 .
,
которая измеряется по шкале Кельвина.
Эти температуры связаны формулой: T
= t
+ 273 .
Средняя кинетическая энергия молекул газа связана с температурой формулой:
E
=
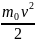 =
=
 kT
, k
= 1 38×
kT
, k
= 1 38×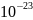 Дж/К
– постоянная Больцмана.
Дж/К
– постоянная Больцмана.
Микроскопические и макроскопические параметры газа связаны между собой формулой:
P
=
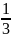 n
n
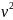 - это основное уравнение м.к.т.
- это основное уравнение м.к.т.
n
=
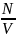 - это концентрация молекул, т.е. количество
молекул в 1
- это концентрация молекул, т.е. количество
молекул в 1
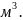
10 Класс. Зачёт № 3. Опорный конспект № 2
Тема “ Уравнение состояния идеального газа”
У газа, находящегося в закрытом сосуде, можно измерить три основных параметра:
давление
газа Р [ ПА ], объём V
[
], температуру Т
.
Если газ находится при нормальных
условиях, то его давление
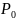 =
=
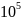 Па, температура
Па, температура
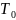 =
273 К, объём 1 моля газа
=
273 К, объём 1 моля газа
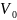 =
0,0224
.
Основные параметры газа связаны между
собой уравнением Клапейрона-Менделеева:
P
V
=
R
T
, где R
= 8,3 Дж/К моль – универсальная газовая
постоянная. Если масса газа в сосуде не
меняется, то уравнение Клапейрона-Менделеева
можно записать так, чтобы в левой его
части находились переменные Р, V,
Т, а справа постоянные величины m,
M,
R,
T,
т.е.
=
0,0224
.
Основные параметры газа связаны между
собой уравнением Клапейрона-Менделеева:
P
V
=
R
T
, где R
= 8,3 Дж/К моль – универсальная газовая
постоянная. Если масса газа в сосуде не
меняется, то уравнение Клапейрона-Менделеева
можно записать так, чтобы в левой его
части находились переменные Р, V,
Т, а справа постоянные величины m,
M,
R,
T,
т.е.
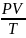 =
RT
- это означает, что при изменении одного
из параметров два других тоже меняются,
но отношение
остаётся прежним.
=
RT
- это означает, что при изменении одного
из параметров два других тоже меняются,
но отношение
остаётся прежним.
Например: измеряют параметры газа до и после сжатия.
1 состояние газа 2 состояние газа
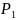 ,
,
,
,
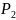 ,
,
,
,


 А
А
газ
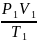 =
=
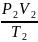 газ
газ
Из последней формулы можно получить законы изопроцессов. Изопроцесс – это процесс, при котором один из параметров данной массы газа остаётся постоянным.
Изотермический постоянная температура |
Изобарный постоянное давление |
Изохорный постоянный объём |
Произведение давления газа на его объём остаётся постоянным
График зависимости давления газа от объёма называется изотермой.
0 V
|
Отношение объёма газа к его абсолютной Температуре остаётся
постоянным
График зависимости объёма газа от температуры называется изобарой.
|
Отношение давления газа к его абсолютной температуре остаётся постоянным
график зависимости давления газа от температуры называется изохорой.
|

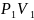 =
=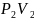
 Р
Р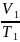 =
=
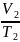
 V
V

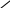 0
Т
0
Т
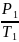 =
=

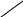 Р
Р
 0
Т
0
Т