
- •1. Основные и производные единицы измерения в си. Правило вывода производных единиц измерений.
- •3. Траектория. Длина пройденного пути. Перемещение. Скорость. Ускорение.
- •4. Равномерное прямолинейное движение. Кинематические уравнения пути и скорости.
- •5. Динамика. Законы Ньютона.
- •6. Виды сил в механике: сила всемирного тяготения, сила тяжести, сила реакции опоры, сила трения, вес, сила упругости.
- •7. Импульс тела. Закон сохранения импульса.
- •8.Работа силы. Мощность. Механическая энергия: кинетическая и потенциальная. Закон сохранения энергии.
- •9. Основные положения молекулярно-кинетической теории и их опытное обоснование. Агрегатное состояние вещества с точки зрения молекулярно-кинетической энергии.
- •11. Идеальный газ. Микроскопические и макроскопические параметры газа. Основное уравнение молекулярно-кинетической теории.
- •12. Термодинамическая шкала температур. Абсолютный ноль. Термодинамические параметры газа. Вывод объединенного газового закона.
- •14. Изотермический, изохорический, изобарический процессы.
- •15. Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам. Адиабатический процесс.
- •16. Виды теплообмена. Изменение внутренней энергии при теплообмене. Уравнение теплового баланса.
- •18. Абсолютная и относительная влажность воздуха. Точка росы. Прибор для определения относительной влажности воздуха.
- •19. Характеристика жидкого состояния вещества. Поверхностный слой жидкости. Сила поверхностного натяжения. Смачивание. Капиллярные явления.
- •20. Электризация тел. Закон сохранения зарядов. Закон Кулона. Диэлектрическая проницаемость среды. Единица измерения электрического заряда.
- •21. Напряженность- силовая характеристика электрического поля. Напряженность поля уединённого заряда. Принцип суперпозиции полей. Графическое изображение электрических полей.
- •23. Конденсаторы, их устройство и назначение. Электроемкость плоского конденсатора.
- •24. Последовательное и параллельное соединение конденсатора в батарею. Энергия заряженного конденсатора.
- •25. Электрический ток. Сила тока. Плотность тока. Условия существования тока. Электродвижущая сила источника электрической энергии.
- •27. Сопротивление металлов. Зависимость сопротивления от рода материала, длинны, площади поперечного сечения и температуры.
- •28. Последовательное и параллельное соединение потребителей электрической энергии.
- •29. Закон Ома для полной цепи с одной эдс. Соединение одинаковых источников электрической энергии в батарею.
- •30. Работа и мощность электрического тока. Тепловое действие электрического тока. Короткое замыкание.
- •31. Ионизация газов. Виды разрядов в газе при атмосферном давлении.
- •32. Электролитическая диссоциация. Электролиз. Законы Фарадея.
- •33. Полупроводники чистые и примесные.(p-n типа)
- •34. Устройство, принцип работы и назначение полупроводникового диода и транзистора.
- •35. Магнитное поле, как особый вид материи. Графическое изображение магнитных полей. Свойства линий индукции.
- •36. Взаимодействие параллельных токов. Магнитная проницаемость среды.
- •37.Действие магнитного поля на проводник с током. Сила Ампера. Рамка с током в магнитном поле. Магнитный момент.
- •39.Действие магнитного поля на движущиеся заряды. Сила Лоренца.
- •40. Явление электромагнитной индукции. Опыты Фарадея.
- •41. Э.Д.С. Индукции для движущегося, прямолинейного, и замкнутого проводника. Правило Ленца.
- •42.Явление самоиндукции. Эдс самоиндукции.
- •43. Получение переменного тока. Индукционный генератор. Период и частота переменного тока.
- •44. Активное, индуктивное и емкостное сопротивления в цепи переменного тока.
- •45. Последовательное соединение в цепи переменного тока. Полное сопротивление. Полное напряжение.
- •46. Трансформатор. Преобразование переменного тока.
- •47. Свободные электромагнитные колебания. Частота и период собственных колебаний. Затухающие и вынужденные колебания. Явление резонанса.
- •48. Электромагнитное поле как особый вид материи. Электромагнитные волны. Открытый колебательный контур.
- •49. Амплитудная модуляция. Устройство и принцип работы простейшего радиоприемника.
- •50. Корпускулярная, волновая и квантовая теории света. Волновые и квантовые свойства света. Формула Планка.
- •51. Законы отражения и преломления света. Полное отражение света. Предельный угол.
- •52. Нету
- •53. Интерференция световых волн. Необходимое условие интерференции. Интерференция света в тонких плёнках.
- •54. Дифракция, дисперсия и поляризация света.
- •55. Цвета тел. Получение спектра. Спектральный анализ. Виды секторов.
- •56. Диапазон электромагнитных излучений, их свойства и применение.
- •57. Внешний фотоэффект. Опыт Столетова. Законы внешнего фотоэффекта.
- •58. Уравнение Эйнштейна для внешнего фотоэффекта. Красная граница фотоэффекта.
- •59. Теория Бора. Строение атома водорода.
- •66. Ядерное топливо. Ядерный реактор.
11. Идеальный газ. Микроскопические и макроскопические параметры газа. Основное уравнение молекулярно-кинетической теории.
m0-масса одной молекулы, m0=M/N,
Давление, объем и температура(м3,Па,К) – эти три величины называются термодинамическими параметрами. Они характеризуют состояние вещества. (Макроскопические величины) Скорость, Масса, импульс, кинетическая энергия – микроскопические величины. (параметры, характеризующие отдельно взятую частицу.
К-постоянная Больцмана=1,380*10-23Дж*К
PV/T=NK, m-const, T0 =273К, P0=1,013*105Па (норм условия)
Идеальный газ – это такой газ, молекулы которого не взаимодействуют друг с другом. (8-й группы)
12. Термодинамическая шкала температур. Абсолютный ноль. Термодинамические параметры газа. Вывод объединенного газового закона.
Д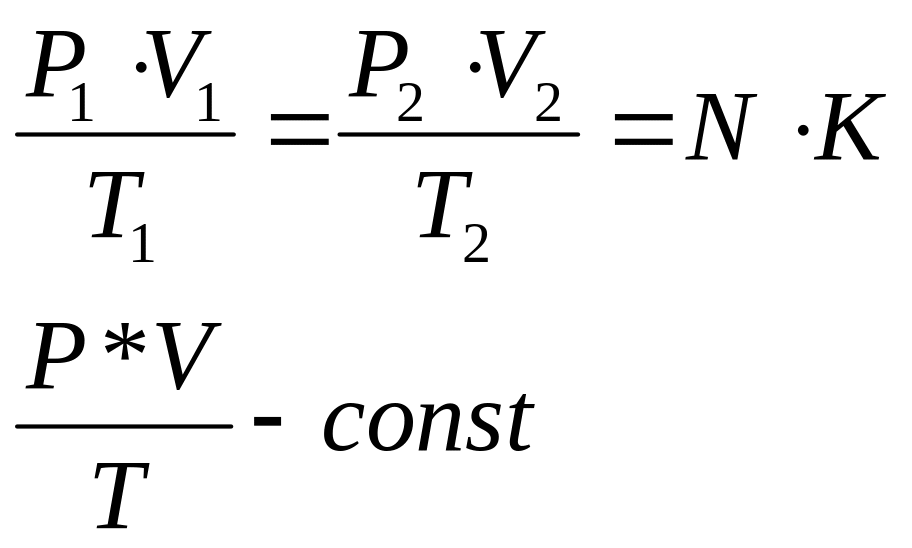 авление,
объем и температура – эти величины
называются термодинамическими
параметрами, потому что они характеризуют
состояние газа.
авление,
объем и температура – эти величины
называются термодинамическими
параметрами, потому что они характеризуют
состояние газа.
Газ Закон:
m-const
1) начало процесса (P1,V1,T1), 2)конец процесса (P2,V2,T2)
Закон: При постоянной массе газа произведение давления на объем и деленное на температуру – есть величина постоянная для любого состояния.
Физическая величина, характеризующая степень нагретости тела – называется темп. Темп измеряется термометрами, принцип их действия основан на явлении объёмного расширения и сжатия при нагревании и охлаждении. t=00C– темп таяния льда или замерзания воды(273К), 1000C– кипения воды(373К).Кельвин создал термодинамическую шкалу темпер. t=-2730 C=0K(T), T=(t0+2730)K
t =-2730C (0К)– называют абсолютным нулем, т к при этой температуре должно прекратиться поступательное движение молекул вещества.
13. Вывод уравнения Менделеева-Клайперона. Универсальная газовая постоянная.
R- универсальная газовая постоянная=8,31 Дж/К*моль.
Запишем объединенный газовой закон для одного моля вещества при норм условиях.
P-давление(Па), V-объем(м3), T-температура(К), N-число молекул вещества, K-постоянная Больцмана(1,380*10-23Дж*К), P0-норм давление(1,013*105 Па) Vm-молярный объем(22,4*10-3м3) T0-норм температура(237К), NA-число Авагадро(6,02*1023).
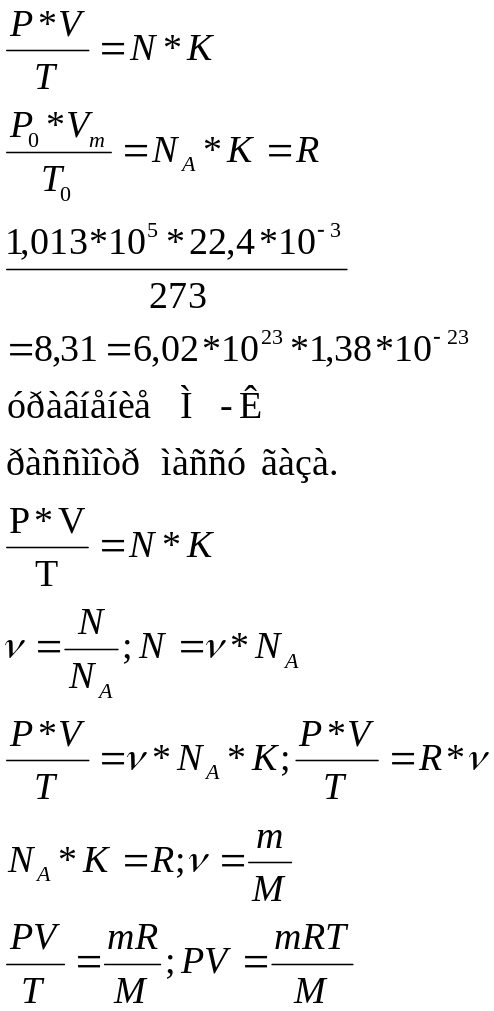
14. Изотермический, изохорический, изобарический процессы.
Процессы, проходящие в газах, при постоянной массе и одном неизменном термодинамическом параметре(P,V,T) называются изопроцессами.
1) Изохорический процесс.(m-const, V-const)
а)начало: (P1,V1,T1), б)нагревание(P2,V2,T2): P1/ P2= T1/T2- закон Шарля.
Закон:При постоянной массе и неизменном объеме, давление газа прямо пропорционально его температуре.
2)Изобарический процесс(m-const, P-const)
а)начало(P1,V1,T1), б) охлаждение(P2,V2,T2):V1/V2=T1/T2-Гей-Люсака
Закон: При постоянной массе и неизменном давлении объем газа прямо пропорционален его температуре.
3) Изотермический.(m-const, T-const)
а)начало(P1,V1,T1), б)конец(P2,V2,T2):V1*P1=V2*P2- Бойля-Мариотта.
Закон: При постоянной массе и неизменной температуре, давление обратно пропорционально объему.
15. Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам. Адиабатический процесс.
Первый закон: Изменение внутренней энергии тела равно сумме полученной телом теплоты и совершенной над ним работой.
ΔU=Q+A, A-работа внешних сил, Q-подведение тепла, ΔU-изменение внутренней энергии,
Количество теплоты, переданное телу, идет на увеличение его внутренней энергии и на работу, совершаемую телом против внешних сил.
Q=ΔU+A’, A’=-A.
1)Изотермический процесс.
m-const, T-const, Q=ΔU+A’, U=3/2* m/M*R*ΔT, ΔT=0, ΔU=0, Q=A’-формула первого начала термодинамики для изотермического процесса.
2) Изохорический.
m-const, V-const, ΔV=0, A=P*ΔV, A’=0
Q=ΔU – формула первого начала термодин для изохор процесса.
3)Изобарический процесс.
m-const, P-const, Q=ΔU+A- формула первого начале термодинамики для изобра проц.
4) Адиобатный процесс.
Это процесс, проходящий без обмена теплом с окружающей средой. Q=0, A=ΔU, 0=ΔU+A’, A’=-ΔU.
