
- •1 Основные положения и основные задачи мкт
- •2.Экспериментальное обоснование мкт
- •3. Основное уравнение кинетической теории газов
- •4.Законы идеального газа
- •5)Давление газа
- •6) Средняя энергия молекул
- •7) Распределение Максвелла
- •8.Барометрическая формула
- •9. Распределение Больцмана
- •10. Экспериментальная проверка
- •11. Закон Максвелла – Больцмана
- •12.Смесь газов в сосуде.
- •13.Разделение вещества на центрифуге
- •14. Подъемная сила
- •15. Внутренняя энергия термодинамической системы
- •16. Работа и теплота
- •17. Первый закон термодинамики (1 начало)
- •18. Теплоемкость. Уравнение Майера.
- •19.Адиабатический процесс
- •20.Политропический процесс
- •21. Работа при изопроцессах.
- •22.Обратимые и необратимые процессы
- •23.Энтропия
- •24.Физический смысл Энтропии.
- •25. Теорема Нернста
- •26. Расчет изменения энтропии в процессах идеального газа
- •27. Второе начало термодинамики.
- •28. Кпд Тепловой машины
- •29. Цикл Карно
- •30)Теорема Карно
- •31.Тепловые машины
- •32. Термодинамические потенциалы
- •1.Внутренняя энергия u
- •2. Свободная энергия f
32. Термодинамические потенциалы
Все расчеты в термодинамике основываются на использовании функций состояния – термодинамических потенциалов. Каждому набору параметров – свой термодинамический потенциал. Изменения потенциалов определяют либо совершаемую системой работу, либо получаемую системой теплоту.
Используем TdS ≥ d’Q (обратимые и необратимые процессы). Термодинамические потенциалы являются функциями состояния Þ приращение любого из потенциалов равно полному дифференциалу функции, которой он выражается.
1.Внутренняя энергия u
dU = TdS – pdV Þ (JU/JS)v = T; (JU/JV)s = - p Þ d’Q = dU + d’A Þ без теплообмена d’A = - dU Þ
A = U1 – U2, т.о., работа равна убыли внутренней энергии.
При V = const Þ d’Q = dU Þ Cv = (JU/JT)v.
2. Свободная энергия f
Обратимый изотермический процесс Þ d’A = - dU + TdS = - d(U – TS) Þ F = U - TS – свободная энергия тела Þ d’A = - dF Þ A = F1 – F2 (T = const, обратимый) При изотермических процессах F – аналог U при
адиабатических процессах. Необратимые процессы d’Q < TdSÞd’A = d’Q – dU, T = const, необр. Þ A < F1 – F2 Þ убыль свободной энергии определяет верхний предел количества работы, которую может совершить система при изотермическом процессе.
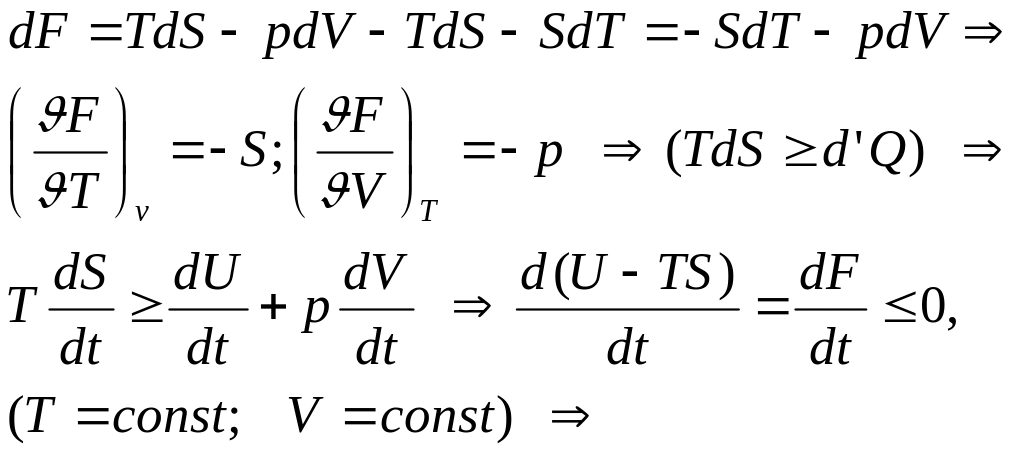
Необратимый процесс, протекающий при постоянных температуре и объеме, сопровождается уменьшением свободной энергии тела. По достижении равновесия F не меняется с t Þ при неизменных V и T – равновесное состояние – при F минимальной.
3. Энтальпия H
p
= const
Þ
d’Q
= dU
+ pdV
= d(U
+ pV)
Þ
H
= U
+ pV
– энтальпия
или тепловая функция Þ
d’Q
= dH
Þ
Q
= H2
– H1
Þ
dH
= TdS
– pdV
+ pdV
+ Vdp
= TdS
+ Vdp
Þ
![]() энтальпия есть термодинамический
потенциал в переменных S
и р.
энтальпия есть термодинамический
потенциал в переменных S
и р.
![]() При постоянном
давлении энтальпия аналогична внутренней
энергии при постоянном объеме.
При постоянном
давлении энтальпия аналогична внутренней
энергии при постоянном объеме.
4. Термодинамический потенциал Гиббса G
Т/д потенциал Гиббса определяется так: G = H – TS = U + pV – TSÞ (полный дифференциал) dG = TdS + Vdp – TdS – SdT = Vdp – SdT Þ (JG/Jp)T = V; (JG/JT)p = -S Þ d(U + pV – TS)/dt = dG/dt £ 0 (T = const; p = const) Þ необратимый процесс, протекающий при постоянных Т и р, сопровождается уменьшением G. По достижении равновесия G перестает изменяться с t Þ при неизменных Т и р - равновесное состояние
– состояние, при котором G минимален.

