
- •Одержання
- •Солі – це речовини, які при дисоціації утворюють йони основних і кислотних залишків.Солі поділяють на середні(нормальні), кислі та основні. Класифікація
- •Способи добування
- •Властивості
- •Середні солі
- •Кислі солі
- •Основні солі
- •Ковалентний неполярний зв'язок
- •Найважливіші окисники й відновники
- •Закон діючих мас в хімічній термодинаміці
- •Гомогенний каталіз
- •Гетерогенний каталіз
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •2. Температура кипіння і замерзання розчинів
- •32 Розчини електролітів. Електроліти - це речовини, які проводять електричний струм в розчиненому або розплавленому стані. Основні положення теорії електролітичної дисоціації
- •Зв'язок константи дисоціації і ступеня дисоціації
- •Класифікація
- •37 Реакції обміну між розчинами електролітів. Йонні рівняння
- •38 Гідроліз солей
- •Фізичні властивості
- •Хімічні властивості
Гетерогенний каталіз
Легкість відділення газової або рідкої реакційної суміші від твердого каталізатору послугувала причиною широкого використання гетерогенного каталізу. Більшість нині існуючих промислових процесів — реакції між газоподібними реагентами за участі твердих каталізаторів.
Процес каталізу на поверхні твердого каталізатору відбувається в кілька елементарних стадій:
дифузія реагентів з потоку речовин до поверхні каталізатору;
хемосорбція у порах поверхні;
перегрупування атомів з утворенням поверхневих комплексів;
десорбція продуктів з поверхні;
дифузія від поверхні до потоку речовин.
Одним з прикладів гетерогенного каталізу є гідрування моноксиду вуглецю на поверхні залізо-родієвого каталізатору:
Залежність швидкості реакції від концентрації реагентів
Будь-яка реакція може здійснюватися тільки за умов зіткнення молекул реагуючих речовин, тому швидкість реакції насамперед залежить від числа зіткнень, яке пропорційне концентрації реагентів. Ця закономірність була встановлена Гульдбергом і Вааге (1867 р.) і одержала назву закону діючих мас, який був сформульований таким чином:
швидкість хімічної реакції пропорційна
добутку концентрацій реагуючих речовин
у ступенях, які дорівнюють стехіометричним
коефіцієнтам, що стоять перед формулами
відповідних речовин у рівнянні реакції.
Вплив температури на швидкість реакції
Підвищення температури зумовлює зростання загальної енергії реакційної системи, а це, в свою чергу, сприяє підвищенню швидкості руху і збільшенню віднос-
ного вмісту активних молекул. Вплив температури на швидкість реакції оцінюється за допомогою емпиричного правила Вант-Гоффа:
підвищення температури на кожні 10 градусів
збільшує швидкість реакції приблизно у 2-4 рази
V2 = V1 (T2-T1)/10, (36)
де Т2 – Т1 = Т – збільшення температури, V1 i V2 – почат-
кова і кінцева швидкість реакції, - температурний коефіцієнт швидкості, значення якого для ендотермічних реакцій вище, ніж для екзотермічних (енд > екз). Для більшості реакцій змінюється у межах 2-4.
ВПЛИВ ТИСКУ НА ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ
Тиск впливає тільки на реакції, що протікають в газовій фазі. Збільшення тиску призводить до збільшення концентрації, а отже, і швидкості реакції.
Оборотні і необоротні реакції , типи реакцій хімічних . Реакцію називають оборотною, якщо її напрям залежить від концентрацій речовин — учасників реакції. Наприклад, в разі гетерогенно-каталітичної реакції N 2 + 3h 2 = 2nh 3 (1)
при малій концентрації аміаку в газовій суміші і великих концентраціях азоту і водню відбувається утворення аміаку; навпаки, при великій концентрації аміаку він розкладається, реакція йде у зворотному напрямі. Після закінчення оборотної реакції, тобто досягши рівноваги хімічного, система містить як вихідні речовини, так і продукти реакції. Реакцію називають необоротною, якщо вона може відбуватися лише в одному напрямі і завершується повним перетворенням вихідних речовин на продукти; приклад — розкладання вибухових речовин. Одна і та ж реакція залежно від умов (від температури, тиску) може бути істотне обратіма або практично необратіма.
Проста (одинстадійна) оборотна реакція складається з двох що відбуваються одночасно елементарних реакцій, які відрізняються одна від одної лише напрямом хімічного перетворення. Напрям доступною безпосередньому спостереженню підсумкової реакції визначається тим, яка з цих взаємно-зворотних реакцій має велику швидкість. Наприклад, проста реакція
N 2 O 4 Û 2no 2 (2)
складається з елементарних реакцій
N 2 O 4 ®2NO 2 і 2no 2 ®N 2 O 4 .
Для оборотності складної (багатостадійною) реакції, наприклад реакції (1), необхідно, щоб були обратіми всі складові її стадії.
Хімічна рівновага - стан хімічної системи, в якому оборотно протікає одна або кілька хімічних реакцій, причому швидкості в кожній парі пряма-зворотна реакція рівні між собою. Для системи, що перебуває в хімічному рівновазі, концентрації реагентів, температура і інші параметри системи не змінюються з часом.
А 2 + В 2 ⇄ 2AB
Константа рівноваги (рос. константа равновесия, равновесное отношение; англ. equilibrium constant, equilibrium ratio; нім. Gleichgewichtskonstante f) –
1) Відношення пружності пари індивідуального вуглеводню Q до тиску суміші вуглеводнів рс:
k = Q/pc.
2) Відношення молярної частки уі і-ого компонента багатокомпонентної системи в паровій (газовій) фазі до молярної частки хі цього ж компонента в рідинній фазі при даних тиску і температурі або відношення тиску насиченої пари рі і-ого компонента багатокомпонентної системи при заданій температурі до тиску р в багатокомпонентній системі при цій же температурі, тобто . Визначена таким чином константа рівноваги зберігає свою величину до тисків у декілька десятих МПа.
Принцип Ле Шательє. Система знаходиться в стані рівноваги доти, доки умови залишаються сталими, якщо змінити одну з умов, за яких встановилась рівновага(концентрацію, температуру або тиск), то відбувається зсув рівноваги в напрямку процесу, який протидіє цій зміні.
28 Загальна характеристика розчинів. Розчин — однофазна, гомогенна, багатокомпонентна система змінного хімічного складу. Практично усі рідини, що є в природі, являють собою розчини. Крім розчиних, існують газові (газуваті) розчини — їх прийнято називати газовими сумішами (наприклад, повітря) і тверді розчини (наприклад, деякі сплави). Як правило, під розчином розуміють рідку молекулярно-дисперсну систему (так звані істинні розчини, англ. true solution). Розчинником називають компонент, концентрація якого суттєво більша концентрації інших компонентів. Розчинник у чистому вигляді має той самий агрегатний стан, що й розчин. Процес утворення розчину полягає у руйнуванні зв'язків між молекулами (йонами) вихідної речовини і утворенні нових зв'язків між молекулами (йонами) розчиненої речовини і розчинника. За концентрацією розчиненої речовини розчини поділяють на насичені, ненасичені й пересичені. За наявністю чи відсутністю електролітичної дисоціації розчиненої речовини на йони розрізняють розчини електролітів і розчини неелектролітів. Крім того, виділяють розчини полімерів, головна особливість яких — дуже велика різниця у розмірах молекул розчинника і розчиненої речовини.
У розчинах протікає багато природних і промислових процесів. З ними пов'язане формування покладів ряду корисних копалин, їх видобування і переробка, розділення речовин, глибоке очищення тощо.
За своїми властивостями розчини займають проміжне місце між механічними сумішами і хімічними сполуками. Від механічних сумішей вони відрізняються головним чином своєю однорідністю і виділенням або поглинанням тепла при утворенні, а від хімічних сполук тим, що склад їх не сталий і може змінюватись у досить широких межах.
Розчини характеризуються також рядом певних властивостей, відмінних від властивостей їх складових частин. Зокрема, вони відрізняються від своїх складових частин густиною, температурою замерзання і кипіння і іншими властивостями. Розчини можуть бути в рідкому, твердому і газоподібному стані. Прикладом перших можуть служити розчини цукру, солі іспирту у воді. Тверді розчини — це різні металічні сплави: міді або срібла в золоті, нікелю в міді тощо. Газоподібними розчинами є суміші різних газів, наприклад повітря.
Наси́чений ро́зчин — розчин, в якому розчинена речовина за даних умов досягла максимальної концентрації і більше не розчиняється. Осад даної речовини знаходиться в рівноважному стані з речовиною в розчині.
При виготовленні насиченого розчину до розчинника додають звичайно таку кількість розчинюваної речовини, щоб частина її залишалася нерозчинною, скільки б розчин не розмішували і не збовтували. Однак у практиці звичайно користуються ненасиченими розчинами, тобто такими, в яких при даній температурі розчинювана речовина може ще розчинятися (до утворення насиченого розчину).
Крім насичених і ненасичених, відомі ще так звані пересичені розчини, в яких розчинюваної речовини в розчиненому стані більше, ніж потрібно для одержання насиченого розчину. Але пересичені розчини зустрічаються порівняно рідко, і їх утворюють лише деякі речовини, наприклад декагідрат сульфату натрію — Na2SO4•10H2O, пентагідраттіосульфату натрію — Na2S2O3 • 5H2O тощо. Пересичені розчини дуже нестійкі і досить легко розкладаються з виділенням надлишку розчиненої речовини і утворенням насиченого розчину.
Ненасичений розчин, розчин, в якому вміст розчиненої речовини менший, ніж в насиченому розчині .
При розчиненні завжди проходить взаємодія розчиненої речовини з розчинником, так звана сольватація. Теплоту розчинення можна розглядати як суму теплот відповідного фазового переходу (ф.п.) і сольватації:
"Hp = "Hф.п. + "Нсольв.
Аналогічно для ентропії матимемо:
"Sp = "Sф.п. + "Sсольв.
Для випадку розчинення кристалічних речовин в рідинах перший доданок в цих рівняннях відповідає руйнуванню кристалічної гратки, тому "Нф.п.>0 і "Sф.п.>0. Сольватація є процесом екзотермічним ("Нсольв<0), а тому теплота розчинення, яка є сумою "Нф.п. і "Нсольв, може мати різний знак. Сольватація означає впорядкований стан системи (проходить орієнтація частинок). Отже, "Sсольв<0, але за абсолютною величиною "Sсольв невелика, а тому розчинення, як правило, супроводжується зростанням ентропії.
29
Способи вираження складу розчинів. Склад розчину можна виражати якісно й кількісно. Розчини з відносно низьким вмістом розчиненої речовини називають розведеними, а з відносно високим — концентрованими. Якісна оцінка досить умовна, бо для розчинів різних речовин ці поняття мають свої обмеження. Кількісний склад розчину визначається концентрацією.
Концентрація — це безрозмірна або розмірна величина, яка виражає співвідношення компонентів у системі. Для системи, що складається з розчинника та розчиненої речовини, концентрацією (не розчину, а розчиненої речовини) називають кількість розчиненої речовини, що міститься в певній кількості розчину або розчинника.
Розчинністю речовини називають здатність її розчинятися в тому чи іншому середовищі. Мірою розчинності або коефіцієнтом розчинності служить кількість грамів речовини, яка при даній температурі розчиняється в 100 г води з утворенням насиченого розчину.
30 О́смос - спонтанний перехід, однобічна дифузія через напівпроникну перегородку (мембрану), яка відокремлює розчин від чистого розчинника або розчину меншої концентрації. Зумовлений прагненням системи до термодинамічної рівноваги і вирівнювання концентрацій розчину з обох боків мембрани. Характеризується осмотичним тиском, що дорівнює надлишковому зовнішньому тискові, який треба докласти з боку розчину, щоб припинити осмос. Відіграє важливу роль у фізіологічних процесах, використовується при дослідженні полімерів, біологічних структур.
Осмоти́чний ти́ск (або дифу́зний ти́ск) — термодинамічний параметр, що характеризує прагнення розчину понизити свою концентрацію при зіткненні з чистим розчинником внаслідок зустрічної дифузії молекул розчинника та розчиненої речовини.
Вант-Гоффа закон осмотичного тиску, визначає тиск молекул розчиненої речовини на напівпроникну перетинку, що відокремлює розчин від чистого розчинника і непроникну для розчиненої речовини
31 У 1987 році французький фізик Рауль встановив закон: відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини N2.
![]()
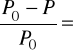 N2.
N2.
